Созревание дендритных клеток человека из моноцитов благодаря BioBran
Д. Шолуджова, Ж. Якубикова, Ж. Седлак, Словакия
Аннотация
BioBran, модифицированный арабиноксилан полученный из экстракта рисовых отрубей, был протестирован на возможное влияние in vitro на созревание дендритных клеток (ДК) человека. Незрелые дендритные клетки (НДК), полученные из пластик-адгезивного интерлейкина-4 (IL-4) и обработанных ГМКСФ моноцитов периферической крови (Мо), были культивированы со смесью цитокинов созревания 1 (CMM1; фактор некроза опухолей альфа, интерлейкин-1ß и интерлейкин-6) или смесью 2 (CMM 2) (липосахарид и интерферон гамма), для индукции созревания зрелых дендритных клеток (matДК1 или matДК2, соответственно). Разные концентрации BioBran (10, 100, 400 и 1000 µг\мл) использовались в присутствии или отсутствии релевантной CMM для оценки эффекта BioBran на процесс созревания ДК. Созревание НДК, доказало эффективность BioBran, так как эти клетки культивированы с интерлейкином-4\ ГМКСФ\ BioBran подавили антигены CD14 и CD1а на клеточной поверхности и значительно повысили экспрессию маркера созревания CD83. Так же было обнаружено повышение плотности поверхности ко-стимулирующих молекул CD80 и CD86 на НДК в присутствии BioBran. Кроме того, BioBran вызвал функциональное созревание НДК, подтвержденное снижением внутриклеточной активности НДК. Также BioBran, усилил потенциал созревания цитокиновых смесей, таких как и matДК1, и matДК2, подверженные воздействию BioBran, полностью утратили CD14 и повысили регуляцию антигенов CD83, CD80 и CD86, в сравнении с ДК, которые созревали только с CMM. BioBran также повысил экспрессию антигена CD123 на всех субпопуляциях ДК. Любопытно, но matДК2, созревающий в присутствии BioBran (400 µг\мл) экспрессировал более высокие уровни поверхностного антигена CD123 и более низкие уровни поверхностного антигена CD11с, фенотип представлен популяцией плазмацитоидных дендритных клеток (ПДК) CD11DIM CD123BRIGHT. Полученные данные демонстрируют, что Биобран является мощным усилителем созревания ДК и предполагают, что BioBran может быть эффективным агентом для создания благоприятных условий для созревания дендритных клеток.
Дендритные клетки – это профессиональные антигенпрезентирующие клетки (APC), которые играют центральную роль в инициации и регуляции ответов иммунной системы, так как они контролируют и врожденную (NK-клетки, NKT-клетки, гамма\дельта Т-клетки) и приобретенную (Т-клетки, В-клетки) иммунную систему. ДК включают в себя субпопуляции с самыми разными характеристиками, которые происходят из клеток-предшественников костного мозга. У человека миелоидные и лимфоидные предшественники могут развиться до CD11DIM CD123BRIGHT миелоидных дендритных клеток (мДК) или CD11DIM CD123BRIGHT плазмацитоидных дендритных клеток (пДК), соответственно. Нагруженные антигенами дендритные клетки переселяются через афферентные лимфатические протоки в дренирующие лимфатические узлы, где они представляют переработанный протеин и липидные антигены Т-клеткам посредством классических (главный комплекс гистосовместимости класс I и класс II) и неклассических молекул антигена. Не активированные НДК представляют антигены Т-клеткам, которые при отсутствии соответствующей ко-стимуляции, приводят к невосприимчивости. При столкновении с патогенами или другими «опасными» веществами, как цитокины, продукты поврежденных тканей или естественные лимфоциты, ДК проходят процесс активации и созревания, при котором они теряют способность захватывать антиген, но приобретают возможность активировать иммунитет. Этот процесс созревания включает в себя изменения в морфологии и подвижности, перемещения комплекса тканевой совместимости на поверхность клетки, повышенную экспрессию ко-стимулирующих молекул (CD80\CD86 и CD40), а также производство цитокинов, что определяет класс иммунного ответа посредством выборочной поляризации развития Т-клеток эффекторов.
Благодаря своей способности инициировать, связывать и регулировать врожденный и приобретенный иммунитет, ДК представляют собой потенциальный инструмент для иммунотерапии рака. И НДК и ПДК обнаружили способность инфильтровать разные типы опухолей человека, но большинство таких клеток были незрелыми. Также, было показано, что несколько опухолевых факторов приводят к торможению созревания ДК, в том числе, IL-10, ФРЭС, ТРФ-бета и простагландин Е2. ДК, столкнувшись с опухолевым антигеном в отсутствие среды про-созревания, остаются в незрелом или полу-зрелом состоянии, и может быть сгенерирована устойчивая реакция. Следовательно, созревание ДК может быть предложено в качестве терапевтической задачи для стимулирования противоопухолевого иммунитета.
BioBran – это растительный препарат, который получают посредством реакции гемицеллюлозы из экстракта рисовых отрубей с множеством ферментов грибов шиитаке. Активный компонент BioBran – арабиноксилан. Предыдущие исследования в лабораторных и естественных условиях показали, что продукт усиливает активность NK-клеток. Задача данного исследования – изучить возможность модулирующего влияния BioBran на дифференцировку и созревание дендритных клеток человека.
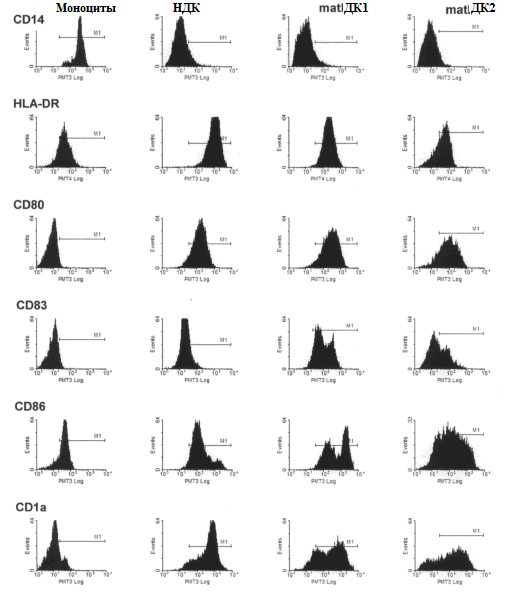
Рисунок 1. Фенотип моноцитов и ДК на разных стадиях созревания в лабораторных условиях (in vitro). Моноциты из периферической крови человека были протестирован при помощи проточной цитометрии и культивированы с ГМКСФ и ИЛ-4 (1000 МЕ\мл) в течение 6 дней, для получения НДК. НДК культивированы в присутствии ГМКСФ и ИЛ-4 еще на 2 дня либо с CMM1, либо с CMM2, для индукции их созревания до matДК1 и matДК2, соответственно. В конце были собраны популяции НДК, matДК1 и matДК2, окрашены флуорохромом. Анализ проводился при помощи проточной цитометрии. Представленный фенотип моноцитов и ДК типичен для более, чем пяти клеточных культур.
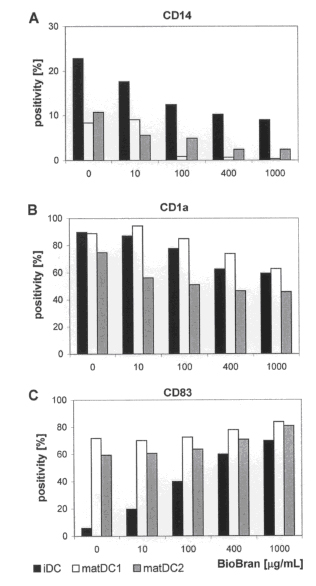
Рисунок 2. Влияние BioBran на антигены дифференцировки\созревания популяции ДК. Экспрессия поверхностных рецепторов CD14, CD1a и маркера CD83 созревания ДК изучалась при помощи проточной цитометрии. Показан процент положительного клеточного ответа, и он является репрезентативным для трех независимых экспериментов.
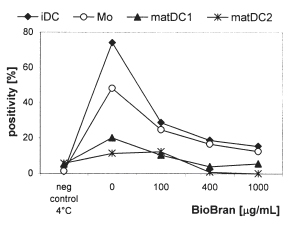
iDC – НКД
positivity – процент положительного клеточного ответа
Mo- моноциты
Neg control – негативный контроль
Рисунок 3. Внутриклеточная активность популяций моноцитов и ДК. Клетки были инкубированы с ФИТЦ-декстраном (1мг\мл) на 60 минут при температуре 37°C и 4°C (для негативного контроля). Дополнительно применялся краситель трипановый синий (0.2%) для гашения флюоресценции. Эндоцитоз оценивался при помощи проточной цитометрии, как процент клеток положительных к декстрану. Результаты являются репрезентативным для трех аналогичных экспериментов, проводимых на клетках разных доноров.
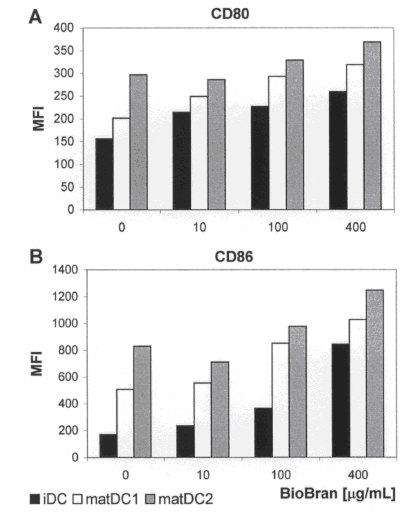
Рисунок 4. Влияние BioBran на экспрессию поверхностных ко-стимулирующих молекул. На поверхности клетки популяций НДК маркеры CD80 и CD86 измерялись при помощи проточной цитометрии, matДК1 и matДК2 в присутствии релевантной комбинации цитокинов без (контрольная группа) или с добавлением BioBran в указанных концентрациях. Результаты средней интенсивности флуоресценции являются репрезентативными для трех независимых экспериментов.
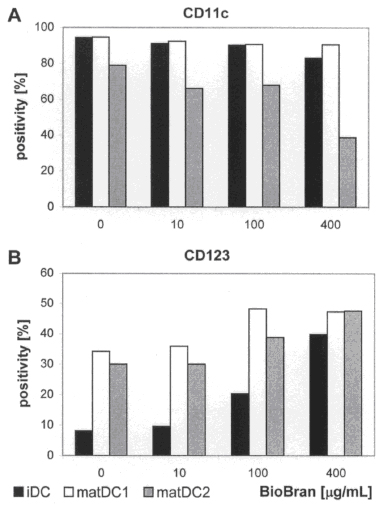
Рисунок 5. Влияние BioBran на экспрессию поверхностных CD11c и CD123. При помощи проточной цитометрии изучался фенотип поверхности ДК (НДК). Результы, показанные здесь типичны для трех независимых экспериментов.
Материалы и методы
Реагенты. Следующие моноклональные антитела были использованы в этом исследовании: флуоресцеинизотиоцианат конъюгированный с антителами CD11c к мышиным моноклональным антителам (IgG1), фикоэритрин, конъюгированный с антителами CD14 (IgG1) к мышиным моноклональным антителам, фикоэритрин, конъюгированный с антителами CD45 (IgG1) к мышиным моноклональным антителам, фикоэритрин, конъюгированный с антителами CD123 (IgG1) к мышиным моноклональным антителам, фикоэритрин, конъюгированный с антителами CD80 (IgG1) к мышиным моноклональным антителам, фикоэритрин, конъюгированный с антителами CD83 (IgG2b) к мышиным моноклональным антителам, фикоэритрин, конъюгированный с антителами CD86 (IgG2b) к мышиным моноклональным антителам, фикоэритрин, конъюгированный с антителами CD1а (IgG1) к мышиным моноклональным антителам и антигены HLADR (дифференцировочный антиген лейкоцитов человека) к мышиным моноклональным антителам. Все антитела и родственные по изотипу контрольные препараты были приобретены в Immunotech Beckman Coulter. Мы также использовали следующие цитокины и лиганды: Рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор (рчГКСФ; Santa Cruz Biotechnology), рекомбинантный человеческий интерлейкин-4 (рчИЛ-4; Santa Cruz), рекомбинантный человеческий интерлейкин-1ß (ИЛ-1ß; Biomol), рекомбинантный человеческий интерлейкин-6 (ИЛ-6; Santa Cruz), фактор некроза опухоли (TNFα; Santa Cruz), липополисахарид (ЛПС; Sigma-Aldrich) и интерферон-γ (IFN-γ; Bender MedSystem)
BioBran – денатурированная гемицеллюлоза, полученная из экстракта рисовых отрубей при помощи ферментов гриба шиитаке (Lentinus edodes). Главная химическая структура и активный компонент – арабиноксилан с ксилозой в главной цепи и полимером арабинозы в боковой цепи. BioBran был предоставлен компанией Daiwa Pharmaceuticals Co. Ltd, Токио, Япония. Исходный раствор BioBran был приготовлен растворением 1 дозы BioBran в 1 000 дистиллированной H2O с конечной концентрацией 1- мг\мл.
Выделение моноцитов периферической крови. Моноциты были выделены из лейкоцитной пленки здоровых доноров (National Transfusion Service, Братислава) при помощи центрифугирования в градиенте плотности (1.077 г/мл, PAN-Biotech, Германия). Были собраны мононуклеарные клетки, отмыты два раза в фосфатно-солевом буферном растворе и один раз в полной среде AIM-V (безсывороточная среда для выращивания и активации лимфоцитов, Gibco-BRL,, Пейсли, Великобритания). Затем были помещены в 6-тилуночные планшеты на 2 часа при температуре 37 °C, 5% CO2. Неприлегающие клетки были аккуратно извлечены и отмыты три раза в фосфатно-солевом буферном растворе и один раз в полной среде AIM-V.
Дифференциация и созревание дендритных клеток. Адгезированные на пластике моноциты были культивированы в 6-ти луночных планшетах на 6 дней в полной среде AIM-V, с ГМКСФ (гранулоцито-макрофаго-колониестимулирующий фактор, 1000 МЕ\мл) и ИЛ-4 (1000 МЕ\л) для генерирования НДК. Через два дня к клеточным культурам была добавлена свежая полная среда с цитокинами. На 7 день среду поменяли, клетки культивировались в полной среде AIM-V с содержанием ГМКСФ (1,000 МЕ\мл) и ИЛ-4 (1,000 МЕ\мл) в присутствии или отсутствии побудителя созревания еще на два дня. Смесь созревания цитокинов 1 (CMM1, TNF-α 10нг\мл), ИЛ-1ß (10 нг\мл) и ИЛ-6 (10 нг\мл), а также смесь созревания цитокинов 2 (CMM2, ЛПС 250нг\мл) и IFN-γ (1000 МЕ\мл) с или без добавления BioBran (10, 100, 400 и 1000 µг\мл) использовались в качестве стимула созревания ДК до matДК1 и matДК2, соответственно.
Иммуннофенотипный анализ клеток. ДК, полученные из моноцитов были собраны, отмыты и заново суспендированы в 0.2% фосфатно-солевого буферного раствора. Аликвоты клеток (50µл\на лунку) были перенесены в 96-ти луночный микропланшет с V-образным дном и инкубированы с 2µл меченными флуоресцином антителами в течение 30 минут при температуре 37°C без света. В конце периода инкубации, для мечения нежизнеспособных клеток, образцы были перенесены в цитометрические пробирки с добавлением 2µ\л 7 амино-актиномицин D (7-ADD; базовый раствор 1 мг\мл в фосфатно-солевом буферном растворе) в 300 µ\л фосфатно-солевого буферного раствора. Образцы были инкубированы на льду в течение 10 минут, в защищенном от света месте и анализировались при помощи проточного цитометра Coulter Epics Altra.
Анализ эндоцитоза с флуоресцеин изотиоцианат-декстран (ФИТЦ). Эффективность эндоцитоза оценивалась, как клеточное поглощение декстрана, конъюгированного ФИТЦ моноцитами, незрелыми и зрелыми ДК (matДК1, matДК2), культивированными в присутствии или отсутствии разных концентраций BioBran (100, 400 и 1000 µг\мл). Для анализа эндоцитоза 2 х105 клетки на образец были инкубированы в среде AIM-V с 1 мг\мл ФИТЦ-декстрана (Mr 40, 000; Sigma) в течение 60 минут при температуре 37 °C (поглощение) и 4°C (негативный контроль). После инкубации клетки были отмыты в ледяном фосфатно-солевом буферном растворе. Дополнительно применялся трипановый синий (0.2%) для гашения флюоресценции. Накопление ФИТЦ-декстрана в клетках измерялось при помощи проточной цитометрии. Нежизнеспособные клетки и зараженные лимфоциты были исключены согласно их параметрам рассеяния и 7 ADD окрашиванию. Значения рассчитывались как изменения в процентном соотношении зеленой флуоресценции между образцами клеток, инкубированных при 37 °C и 4 °C, соответственно.
Проточная цитометрия. Образцы анализировались при помощи четырехцветного проточного цитометра Epics Altra (Beckman Coulter), снабженного аргоновым лазером и работающего при 488 нм. Эмиссия флуорохромов записывалась при помощи полосовых фильтров: ФИТЦ, 525 нм (FL1); фикоэритрин 575 нм (FL2); 7 ADD 675 нм (FL4). Все данные были обработаны при помощи программного обеспечения WinMDI версия 2.7 (J. Trotter, Scripps Research Institute, La Jolla, CA). Для иммунофенотипирования было проведено гейтирование по параметрам бокового светорассеяния. Нежизнеспособные клетки (7 ADD положительные) были исключены из анализа. В среднем было собрано 20 000 клеток.
Результаты
Фенотипичная характеристика моноцитов и ДК, полученных из моноцитов на разных стадиях in vitro созревания. Фенотипичный анализ проводился для подтверждения статуса дифференциации и созревания ДК. Моноциты CD14+ периферической крови человека были изолированы при помощи адгезирования на пластик из лейкоцитарной плёнки здоровых доноров и культивированы в присутствии ГМКСФ и ИЛ-4. В течение двух дней НДК дополнительно обрабатывались двумя смесями созревания цитокинов для получения 2 популяций зрелых ДК. Как показано на Рисунке 1, моноциты экспрессируют CD14 и HLA-DR (человеческий лейкоцитарный антиген). Они также показали низкую положительность CD86, но почти полностью не экспрессировали CD1a, CD83 b CD80. В отличие от моноцитов, НДК подавляли CD14, но сильно экспрессировали с представляющей антиген молекулой CD1a. Была отмечена положительная экспрессия ко-стимулирующих молекул CD80 и CD 86 и экспрессия CD83. Зрелые ДК (и matДК1 и matДК2) значительно повысили экспрессию маркера созревания CD83 и ко-стимулирующих молекул CD80 (B 7-1) и CD 86 (В 7-2).
BioBran модулирует экспрессию маркеров дифференциации и созревания на ДК. Для изучения влияния BioBran на созревание ДК, НДК были обработаны разными концентрациями BioBran (10, 100, 400 и 1000 µг\мл) в присутствии или отсутствии релевантной смеси для созревания (Рисунок 2). Экспрессия на поверхности антигенов CD14, CD1a, CD83 к НДК (matДК1 и matДК2) изучалась при помощи проточной цитометрии на HLA-DR+гейтированные клетки. BioBran подавляет экспрессию маркера моноцитов CD14 (Рисунок 2А) и представляющую антиген молекулу CD1a (Рисунок 2В) на поверхность НДК, но повышает экспрессию CD83 (Рисунок 2С), маркер зрелой ДК. Аналогично НДК, наблюдалось и подавление CD14 и CD1a и повышение регуляции CD83 в обеих популяциях зрелых ДК (matДК1 и matДК2) с повышением концентрации BioBran.
BioBran снижает эндоцитическую активность НДК. BioBran проверили на его способность влиять на эндоцитическую активность моноцитов и ДК, полученных из моноцитов. Эндоцитоз оценивался, как поглощение декстрана, конъюгированного ФИТЦ при температуре 37°C с негативным контролем, инкубированным при температуре 4°C. Необработанные НДК и моноциты показали высокий уровень эндоцитической активности (73% и 48% положительных клеток, соответственно). В то время как matДК1 и matДК2 показали очевидное сокращение поглощения ФИТЦ-декстрана (14.9% и 5.6%, соответственно, Рисунок 3). Значительное сокращение эндоцитической активности НДК, культивированных в присутствии BioBran было подтверждено при сравнении с контрольными НДК. Такое влияние BioBran зависело от дозы (27.7% для 100 µг\мл, 17.7% для 400 µг\мл и 14.4% декстран-положительных клеток для дозы BioBran 1000 µг\мл, Рисунок 3). Аналогичные результаты наблюдались и с моноцитами, когда 100 µг\мл BioBran снизил процентное содержание положительных клеток ФИТЦ-декстрана до 12.7%.
BioBran повышает экспрессию на поверхности ко-стимулирующих молекул CD80 и CD86. Для того чтобы оценить влияние BioBran на экспрессию ко-стимулирующих молекул CD80 и CD86, НДК, полученные из моноцитов, обрабатывались в течение 2 дней BioBran (10, 100, 400 µг\мл) или доводились до состояния созревания при помощи смесей CMM1 и CMM2 в присутствии BioBran. Экспрессия на поверхности CD80 и CD86 изучалась при помощи проточной цитометрии на гейтированных клетках (Рисунок 4). Контрольные клетки matДК2, созревавшие в присутствии ЛПС и IFN-γ обнаружили самые высокие уровни CD80 (среднекратный прирост ~ 296) в сравнении с контрольными matДК1, созревавшими в присутствии ИЛ-1ß, ИЛ-6 и TNF-α (среднекратный прирост ~ 201) или незрелыми ДК (среднекратный прирост ~ 156). Аналогично, matДК2 экспрессировали самые высокие уровни CD86 (среднекратный прирост ~ 829) в сравнении с matДК1 (среднекратный прирост ~ 506) и НКД (среднекратный прирост ~ 170). BioBran повышает среднюю интенсивность флуоресценции ко-стимулирующих молекул CD80 и CD86 в зависимости от дозы на всех популяциях ДК. В присутствии BioBran при концентрации 400 µг\мл, средний прирост CD80 повысился до 368 для зрелых ДК, 319 для ДК и 260 для НДК.
BioBran повышает регуляцию интерлейкина 3 к рецептору α-цепи CD123. Наблюдалось подавление адгезивной молекулы CD11с на поверхности клеток matДК2 в присутствии BioBran (Рисунок 5). BioBran 400 µг\мл индуцировал двукратное повышение положительности CD11c на matДК1 по сравнению с контрольными клетками (от 78.9% до 38.7%). Для сравнения, BioBran повысил положительность CD123 на НДК, зрелых ДК и matДК1 в зависимости от дозы. Самое очевидное влияние BioBran было отмечено на НДК, где BioBran 400 µг\мл индуцировал пятикратное повышение положительности CD123 по сравнению с контрольными клетками (от 8.1% до 39.9%). В присутствии BioBran, субпопуляции НДК, matДК1 и matДК2 экспрессировали более высокие уровни антигена CD123 и более низкие уровни антигена CD11c. Фенотип представлен плазмоцитоидной ДК популяцией CD11DIM CD123BRIGHT.
Обсуждение
BioBran – это продукт, полученный из гемицеллюлозы рисовых отрубей путем ферментации с множеством ферментов грибов шиитаке. В предыдущих исследованиях BioBran показал свое иммуномодулирующее действие на клетки врожденной (NK-клетки, макрофаги) и приобретенной (Т-лимфоциты, В-лимфоциты) иммунной системы. BioBran оказался очень сильным усилителем активности NK-клеток, что сопровождалось секрецией фактора некроза опухоли альфа и интерфероном гамма. BioBran также повышает фагоцитоз макрофагов за счет увеличенного производства TNF-α, ИЛ-6 и окиси азота. ДК – это самые эффективные клетки, представляющие антиген, они играют важную роль в генерации и регуляции противоопухолевого иммунитета. После захвата опухолевых антигенов, НДК испытывают фенотипичные и функциональные изменения и дифференцируют в matДК. Между ДК и NK-клетками существует очень тесное взаимовлияние в начале иммунного ответа против вирусов и против опухолевых клеток. Основываясь на ранее упомянутых эффектах BioBran на активность NK-клеток, мы хотели описать его возможное участи в созревании ДК in vitro.
Мы применили две процедуры созревания, которые используются для подготовки ДК из моноцитов периферической крови. Проточная цитометрия экспрессии антигена на поверхности клетки, а также проверка поглощения гранул декстрана подтвердила эффективное производство и незрелых и зрелых ДК. BioBran показал свою способность уменьшать дифференциацию маркера CD14 в зависимости от дозы и увеличивать дифференциацию маркера CD83 в клетках matДК1 и НДК, соответственно.
Лечение BioBran вызвало усиление экпрессии антигена CD123 в зависимости от концентрации и в зрелых и незрелых ДК и сократило экспрессию CD11 только в matДК2. Таким образом, фенотип зрелых клеток, которые созревались при помощи смеси CMM2 похож на типичный фенотип плазмоцитоидных ДК. Недавно, было описано производство зрелых ДК из клеток CD34+, которые экспресируют маркеры миелоидных и плазмоцитоидных ДК. Здесь также была обнаружена ко-экспрессия антигенов CD123 и CD11с на ДК, полученных из моноцитов, а также наблюдалось поглощение ФИТЦ-декстрана. Эти данные совпадают и с нашими результатами, полученными при объединении BioBran с CMM1.
До сегодняшнего дня, механизмы влияния BioBran в отдельности или с другими препаратами остаются неясными. Кроме иммуномодулирующего эффекта, BioBran также усиливает апоптоз MCF-7 клеток, вызванный дрожжами и сенсибилизирует лейкемические Т-клетки человека к рецептору апоптоза CD95.
Мы полагаем, что BioBran является эффективным модификатором биологического ответа, который может стимулировать ДК созревание и в реальных условиях. ДК являются центральными регуляторами реакций врожденной и приобретенной иммунной системы. Их присутствие в опухолевой микросреде связывают с выживаемостью.
Возможные положительные эффекты BioBran при устранении тормозящих сигналов в опухолевой микросреде, наряду с другими терапевтическими методами, могут служить для успешного преодоления иммунологической недостаточности.
06 Март 2015
06 Март 2015


