Арабиноксилан (MGN-3/Биобран) усиливает клеточно-опосредованную активность NK-клеток в борьбе с нейробластомой in vitro и in vivo
аннотация
исходные цели.
Цитотоксическая активность NK-клеток играет главную роль в иммунологической защите от злокачественных новообразований. NK-клетки появляются в организме как средства для иммунотерапии адоптивного рака. Арабиноксилан (MGN-3/Биобран) был описан как модификатор биологической реакции, который может улучшить цитотоксическую активность NK-клеток. На основании данного исследования был оценен эффект действия MGN-3/Биобран на активность NK-клеток, увеличение их количества и усиление цитотоксичности в отношении клеток нейробластомы. Методы. NK-клетки были обогащены магнитными микроносителями и стимулированы с помощью MGN-3/Биобран. Активность NK-клеток оценивалась с помощью анализа фенотипа, а их способность к размножению отслеживалась. Цитотоксическая способность активированных NK-клеток in vitro была протетстирована в отношении клеточных линий K562, Jurkat, A673, NB1691, A-204, RD и RH-30, цитотоксическая способность in vivo была протестирована в отношении клеточной линии NB1691. Результаты. Стимуляция NK-клеток MGN-3/Биобраном повлекла за собой более высокую экспрессию с ассоциацией рецепторов CD25 и CD69, чем в непростимулированных клетках (P < 0.05). Экспрессия NKG2D, DNAM, NCRs и TLRs осталась неизменной. Одновременно стимуляция MGN-3/Биобран увеличила цитотоксическую активность NK-клеток в отношении всех клеточных линий, протестированных in vitro и уменьшила рост нейробластомы in vivo. Этот механизм не опосредуется контаминацией липолисахаридов в MGN-3/Биобран. Более того, добавление MGN-3/Биобран вызвало прогрессирование увеличение количества NK-клеток и сократило T-клетки in vitro. Выводы. Наши данные показывают, что MGN-3/Биобран вызывает рост NK-клеток с активационными маркерами, стимулирует цитотоксическую активность NK-клеток в отношении нейробластомы in vitro и in vivo и выборочно увеличивает количество NK-клеток. Эти результаты могут быть полезными для будущих терапевтических стратегий лечения нейробластомы NK-клетками.
Введение
Цитотоксическая активность NK-клеток играет основную роль в нашей естественной иммунологической защите от развития злокачественных образований. Факты подтверждают, что сниженнная цитотоксическая активность NK-клеток ассоциируется с более высоким риском развития опухоли у здоровых людей. Кроме того, после трансплантации гематопоэтических стволовых клеток наблюдается высокая цитотоксическая активность NK-клеток, которая ассоциируется со снижением риска рецидива заболевания у пациентов. Цитотоксическая активность NK-клеток может улучшаться за счет здорового образа жизни, модификаторов биологического ответа, гормонов роста и цитокинов. Злокачественные клетки могут снижать цитотоксическую активность NK-клеток за счет продуцирования супрессорных цитокинов и/или снижения числа активирующих рецепторов на NK-клетках. Активность NK-клеток может подавляться антителами и химиотерапевтическими агентами.
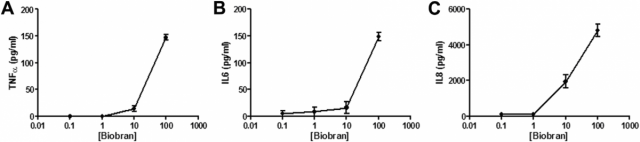
Рисунок 1. Уровни цитокинов в супернатантах культуры были определены с использованием технологии капельной проточной цитометрии Cytometric Bead Array Flex Set (BD Biosciences) и проанализированы с помощью жидкостной цитометрии с использованием жидкостного цитометра BD FACSCalibur (BD Biosciences). (A) TNF-a уровни, (B) IL-6 уровни и (C) IL-8 уровни.
Таким образом, поддержание высокой цитотоксической активности NK-клеток должно быть направлено как на раковых пациентов, так и на здоровое население.
MGN-3/Биорбан – это арабиноксилан из рисовых отрубей, которые были модифицированы с помощью карбогидратных гидролизирующих энзимов грибов shiitake. Было отмечено, что данная пищевая добавка повышает цитотоксическую активность NK-клеток в отношении опухолей взрослых пациентов in vitro и in vivo. Более того, имеются описания синергического противоопухолевого эффекта Биобрана в сочетании с традиционным лечением некоторых раковых опухолей, таких как рак молочной железы и гепатоцелюлярный рак. Эти данные открыли возможность использования MGN-3/Биобрана в качестве вспомогательного метода лечения рака у взрослых пациентов. Однако не имелось никаких данных по использованию препарата для лечения опухолей у детей. Наша цель заключалась в том, чтобы исследовать роль MGN-3/Биобрана в качестве стимулятора NK-клеток против опухолей у детей in vitro и in vivo, а также роль MGN-3/Биобрана в увеличении роста NK-клеток с использованием различных комбинаций цитокинов и стимуляторов клеточных линий.
Методы
Подготовка клеток
Комитет по этике нашего института одобрил это исследование. Периферийные мононуклеарные клетки крови (ПМКК) были выделены с помощью центрифугирования в градиенте плотности из образцов крови, полученных от здоровых волонтёров. Кровь была аккуратно нанесена на равнозначный объем среды Ficoll-Paque Plus (GE Healthcare) и центрифугирована при 400g в течение 20 минут при комнатной температуре. ПМКК были собраны с поверхности, дважды промыты с помощью фосфоросодержащего изотонического раствора (ФИР) и центрифугированы при 400g в течение 10 минут. Затем NK-клетки были обогащены набором магнитных микроносителей (с использованием набора для сепарции NK-клеток или микроносителей CD56; Miltenyi Biotec) (смотрите онлайн на дополнительном рисунке 1 для рецензентов). Цельная кровь была помещена на верхнуюю часть подушки фиколла и центрифугирована при1800 об/мин в течение 30 минут при комнатной температуре. Фракция лимфоцитов/моноцитов была изолирована и промыта с помощью ФИР. Затем пробу подвергли лизису красных кровяных телец (раствор аммониум-хлорида; Stem Cell Technologies) в течение 5 минут при комнатной температуре и дополнительно промыли с поморщью ФИР. Моноциты были культивированы в среде RPMI 1640 medium (Gibco-BRL, Life Technologies Ltd), затем к ним была добавлена 10% фетальная бычья сыворотка в увлажненной атмосфере с 5% CO2 при температуре 37oC. Осажденные на субстрате моноциты были культивированы в течение 7-10 дней для дифференциации макрофагов. Макрофаги использовались в качестве биосенсоров при определении максимальной дозировки MGN-3/Биобран для стимуляции NK-клеток без стимулирования макрофагов.
Реагенты
В исследовании использовались следующие анти-человеческие моноклональные антитела (mAbs): CD3PE-Cy7, CD45-FITC, CD69- FITC и CD314 (NKG2D)-APC (все от компании Becton Dickinson); CD56-APC, CD25-PE, CD336
Таблица I. Быстрое стимулирующее действие Биобран и IL-15 на активацию NK-рецепторов.
|
|
Покой |
Биобран |
IL-15 |
Биобран/коэффициент покоя |
IL-15/коэффициент покоя |
|||
|
MFI |
SD |
MFI |
SD |
MFI |
SD |
|||
|
CD69 |
508.3 |
889.2 |
1591.7 |
741.1 |
18032.6 |
14136.6 |
3.13 |
35.48 |
|
CD25 |
481 |
448.9 |
1537 |
520.3 |
1864 |
2843.8 |
3.2 |
3.88 |
|
NKG2D |
4634.2 |
5762 |
5074.3 |
4761 |
9914.9 |
11491 |
1.09 |
2.14 |
|
DNAM |
1960.6 |
2529 |
2501.1 |
1174 |
3344.8 |
5391 |
1.28 |
1.71 |
|
NKp44 |
1017.7 |
1473 |
1808 |
2780 |
886.3 |
2110 |
1.78 |
0.87 |
|
NKp30 |
1300.7 |
1990 |
1519.8 |
2508 |
4971.5 |
1567 |
1.17 |
3.82 |
|
NKp46 |
1134.4 |
1044 |
1159.4 |
1695 |
1568.8 |
1187 |
1.02 |
1.38 |
|
TLR4 |
2654 |
2858 |
1348 |
2533 |
1963 |
2150 |
0.51 |
0.74 |
|
TLR9 |
5854 |
6284 |
5200 |
6448 |
8779 |
6231 |
0.89 |
1.50 |
Представлены данные MFI, SD, и коэффициенты от 3 здоровых волонтеров контрольной группы. Жирный шрифт указывает на статистическую значимость.
(NKp44)-PE и CD335 (NKp46)-PE (все производства компании Beckman Coulter); CD337 (NKp30)-PE (Miltenyi Biotec). Помеченные флюорохромом mAbs против TLR-4 и TLR-9 были получены из Enzo Life Sciences AG.
Интерлейкин (IL)-15 был получен из CellGe- nix. IL-2 (Пролейкин) был получен из Novartis. MGN-3/Биобран был предоставлен компанией Daiwa Pharmaceuticals Ltd. Липосахарид (LPS; Сигма 0127:B8) был использован в качестве лиганда толл-подобного рецептора-4 (TLR-4), а полимиксин B (InvivoGen) был использован в качестве ингибитора LPS-индуцированной активации TLR-4.
Клеточные линии
Клеточные линии K562 эритролейкемии, Jurkat T лимфоидной лейкемии, A673 опухоли Юинга (все от ATCC), клеточная линия нейробластомы NB1691 (любезно предоставленная доктором А. Давыдовым из Детского Исследовательского Госпиталя Святого Иуды), клеточные линии A-204 эмбриональной рабдомиосаркомы, RD эмбриональной рабдомиосаркомы и RH-30 альвеоларной рабдомиосаркомы (все от DSZM) были использованы в качестве мишеней для испытаний естественной цитотоксичности NK-клеток in vitro. Клеточная линия трансдуцированной люциферазой нейробластомы (NB1691luc) была любезно предоставлена доктором А. Давыдовым и использована in vitro, а также для количественного анализа на мышиной модели in vivo. Облученные линии K562 и K562 с экспрессией мембраносвязанных клеток IL-15 и 4-1BBL (K562-mb15- 41BBL, любезно предоставленная доктором Д. Кампана, Национальный Университет Сингапура) были использованы в качестве питающих клеток для активации и роста NK-клеток.
Фенотипический анализ
Поверхностные фенотипы NK-клеток, стимулированных MGN-3/Биобран (100 Мг/мл), NK-клетки, стимулированных IL-15 (10 нг/мл), нестимулированные NK-клетки и увеличенные в объеме NK-клетки от 3 здоровых взрослых волонтеров были определны с использованием 6-цветной иммуно-флюоресцентной окраски. Мы окрашивали 5 x 105 свежих NK-клеток из различных условий с помощью подходящих мышиных анти-человеческих моноклональных антител в течение 30 минут в темноте при температуре 4oC. Клетки были дважды промыты холодным ФИР, ресуспенсезированы в 0.5 мл ФИР и исследованы с использованием проточного цитометра FACSCanto II (Бектон Дикинсон). Процент позитивных клеток и коэффициенты средней интенсивности флуоресенции (СИФ) были определены для каждого антигена клеточной поверхности. Контроль проводился с использованием подходящих антител для контрольнго изотипа.
Исследования цитотоксичности и стимуляция NK-клеток
Естественная цитотоксчинсоть NK-клеток была отслежена в процессе стандартного двухчасового исследования с европием-2,20:60,200- тирпридином-6,600 -двухосновной кислоты (Перкин-Элмер Уоллок), как описано ранее. Клеточные линии K562, Jurkat, A673, NB1691, A-204, RD и RH-30 были использованы в качестве клеток-мишеней. Клетки-мишени были помечены увеличиваюшим флуоресенцию лигандом (бис(ацетоксиметил) 2,20:60,200-терпиридин-6,600-дикарбоксилат). Этот гидрофобный лиганд быстро проникает внутрь клеточной мембраны. Гидролиз его сложноэфирных связей в пределах клетки приводит к тому, что лиганд становится гидрофильным, и таким образом, не может пройти через клеточную мембрану. Цитолиз, однако, влечет за собой продуцирование лиганда и, в конечном счете, его реакцию с европиумом, в результате которой формируется стабильный флуоресцированного хелата, который оценивается флуорометрически (Infinite F200 reader TECAN Group Ltd). Следующие формулы были использованы для подсчета спонатнной и специфической цитотоксичности:
% Специфическая секреция =
(экспериментальная секреция - спонтанная секреция) / (максимальная секреция - спонтанная секреция) х100
% Спонтанная секреция =
(спонтанная секреция – фон) /
(максимальная секреция –фон) x100
NK-клетки от здоровых волонтеров стимулировались с помощью 100 Мг/мл MGN-3/Биобран, 10 нг/мл IL-15, 40 IU/Мл или 1000 IU/мл IL-2 или с помощью комбинации MGN-3/Биобран и 40 IU/мл IL-2. Культуры обрабатывались в питательной среде (RPMI 1640 в совокупности с 10% термоинактивированной фетальной бычьей сывороткой, 100 IU/мл пеницилином,
100 нг/мл стрептомицином, и 2 ммоль/Л глутамином) в увалжненной атмосфере из 5% CO2 и 95% воздуха. Ц итотоксическая активность оценивалась как описано ранее.
Мышиная модель
Клекти нейробластомы NB-1691luc 2 x 105 были инъекцированы внутривенно NOD-scid IL-2Rgnull мышам в возрасте 12 недель. Для изоляции NK-клеток, мы использовали PBMC от здоровых волонтеров. Затем NK-клетки были обогащены набором магнитных частиц (набор для сепарации NK-клеток, Miltenyi Biotech). Полученные NK-клетки были >90% CD3-CD56. Использовались свежие NK-клетки или NK-клетки, активируемые с помощью 100 Мг/мл MGN-3/Биобран. Внутривенная NK-клеточная терапия началась через 7 дней после инъекции опухолевых клеток и осуществлялась дважды в неделю в течение 4 недель. В двух независимых экспериментах (4 мыши на группу), мы сравнили нелеченный контингент (контрольную группу) с контингентом, получающим 1 x 106 нестимулированные NK-клетки (NK группа) и контингентом, получающим 1 x 106 NK-клетки, стимулированные 100 Мг/мл MGN-3/Биорбан (группа NK-Биобран). Биолюминесцентная интраскопия проводилась после начала терапии NK-клетками на 7-ой, 14-ый, 28-ой и 42-ой дни на фоне интраперитонеальной инъекции 100 мл люциферина, растворенного в ФИР с концентрацией 15 мг/мл.
Через пять минут после введения субстрата, животные были подвержены анестезии с использованием изофлюорана (введение в наркоз на 3%, а затем поддержка на 1,5%), а также Xenogen IVIS Lumina II (количественной флюоресцентной и биолюминесцентной интраскопии, корпорация Xenogen). Снимки были сделаны с различных позиций, а анализ был осуществлен с использованием программного обеспечения для изображения прямой передачи Xenogen (версия 3.2). Для диаграмм биолюминесцентной интраскопии для каждой мыши была определена прямоугольная область исследования, охватывающая весь грудной отдел и живот, суммарный поток (протоны/с), подсчитавался в вентральной позиции и положении лежа при экспозиции 180 секунд. Данное значение было представлено в перерасчете до сопоставимого исходного значения (от люциферин-инъекцированной контрольной мыши-неносителя раковой опухоли). Все эксперименты были проведены согласно нормативам ведомственных комитетов по уходу и использованию животных в соответсвии с критериями, подчеркнутыми в указателях по здоровью национальных институтов по уходу и использованию лабораторных животных.
Активация и увеличение объема NK-клеток
Увеличение объема было достигнуто с помощью 14-дневного изолированного культивирования и культивирования с MGN-3/Биобран 100 мг/мл и цитокинами (100 IU/мл IL-2 или 100 IU/мл IL-2 плюс 10 нг/мл IL-15) или дополнительного со-культивирования с использованием облученных питающих клеток, и клеточных линий, состоящих из клеток K562 или K562-mb15-41BBL. PBMC были получены от 5 здоровых взрослых волонтёров посредством центрифугирования в градиенте плотности (Фиколл). PBMC были выведены в 6-тигранной плоскодонной тарелке с MGN-3/Биобран и цитокинами человека (IL-2, IL-2 ю IL-15) или изолировано, или со-культивированы в пропорции 1:1.5 с помощью сублетальных облученных K562 или K562-mb15-41BBL питающих клеток. В качестве питательной среды использовалась RPMI 1640, в которую была добавлена 10% AB свежезамороженная человеческая плазма, L-глутамин и пенициллин-стрептомицин (Биохром). Свежая среда добавлялась каждые 2 дня. Через 14 дней, клетки были собраны и проанализированы для определения фенотипа и цитотоксичности NK-клеток in vitro NK.
Цитометрический гранулярный слой и исследование проточного цитометра для определения содержания TLR агониста в MGN-3/Биобран
Выработка фактора некроза опухоли (TNF)-a, IL-6 и IL-8 в макрофагах человека после стимуляции LPS (10 нг/мл) или MGN-3/Биобран (при 10, 100, 1000 и 10,000 мг/мл) была обнаружена с помощью цитометрической техники гранулярного слоя Flex Set (BD Biosciences), следуя протоколу фирмы-производителя, а затем проанализировано с помощью проточной цитометрии с использованием проточного цитометра BD FACSCalibur (BD Бионауки). Концентрация MGN-3/Биобран (100 мг/мл) была определена как самая высокая концентрация, которая не вызывала воспаления (повышение TNF-a, IL-6 и IL-8, Рис. 1). MGN-3/Биобран был исследован на потенциальный агонистический эффект на TLR-2, -3, -4, -5, -7, -8 и 9 с помощью InvivoGen. В связи с тем, что следы LPS в MGN-3/Биобран могла повысить цитотоксичность NK-клеток по TLR-4-сигналу, с помощью BioChem GmbH было проведено определение содержания липополисахарида/эндотоксина, лиганда TLR-4, в MGN-3/Биобран (100 мг/мл). Кроме того, мы измерили количество LPS/эндотоксина с помощью хромогенного анализа (Хромогенного токсин-чувствительногоо анализа, набора для исследования эндотоксина LAL, GenScript). Исследования функциональной фитотоксичности в отношении клеточных линий K562 и NB1691 в качестве мишеней in vitro были осуществлены с использованием LPS (10 нг/мл) в качестве стимулятора NK-клеток и полимиксина B (100 мг/мл) в качестве ингибитора LPS-индуцированной активации TLR-4. Наконец, мы осуществили цитотоксические исследования в отношении клеточной линии NB1691 с использованием MGN-3/Биобран-стимулированных NK-клеток с подавлением полимиксином B.
Статистический анализ
Резульаты показаны в форме значений ± SD. Непараметрические тесты Вилконсона были выбраны для сравнения эффекта MGN-3/Биобран на фенотип NK-клеток, цитотоксичность и коэффициент увеличения. В мышиной модели выживание было оценено с помощью одномерного метода Каплана-Мейера и сравнено с использованием логрангового критерия. Статистическое значение было определено как P < 0.05.
Результаты
NK фенотипирование
Добавление MGN-3/Биобран-стимулированных NK-клеток повлекло за собой повышение экспресии CD69 и CD25 от среднего значения равного 9%-88% и 6%-90%, соответственно (Коэффициент MFI увеличился в 3.1 и 3.2 раза соответственно). Проценты и MFI других исследованных рецепторов остались неизменными. IL-15-стимулированные NK-клетки, использованные в качестве положительного контроля, значительно увеличили среднюю экспрессию CD25 (6%-92%, MFI коэффициент увеличился в 3.9 раза), CD69 (9%-98%, MFI коэффициент увеличился в 35.5 раз), NKG2D (92%-97%, MFI коэффициент увеличился в 2.1 раза), DNAM (от 81% до 96%, MFI коэффициент увеличился в 1.7 раза) и NKp30 (от 54 до 81, MFI увеличился в 3.8 раза). Таблица I и Рис. 2 A и B показывают реакцию активирующих рецепторов на NK-клетки при круглосуточном стимулировании MGN-3/Биобран и IL-15.
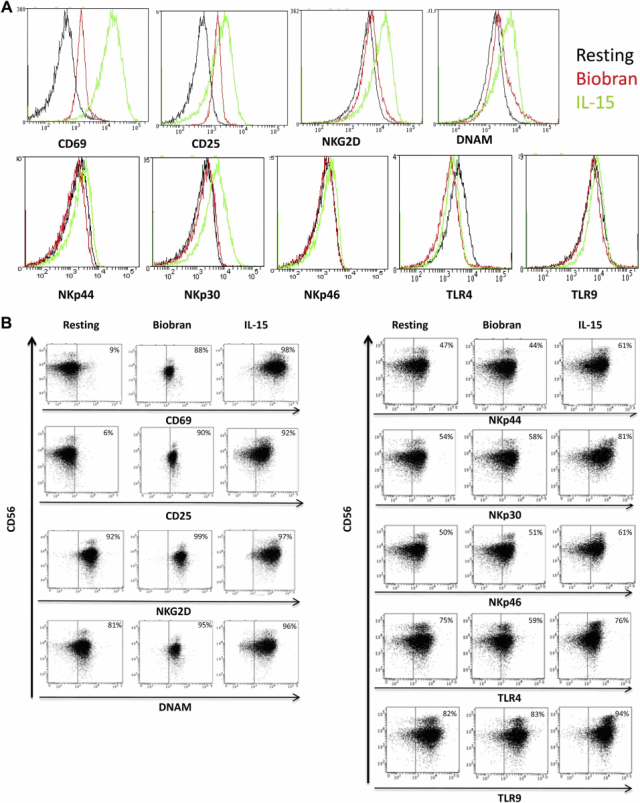
Рисунок 2. (A) Средняя интенсивность флуоресценции при активации рецепторов NK-клеток: в состоянии покоя (черный цвет), MGN-3/Биобран (красный цвет) и IL-15 стимулированный (зеленый цвет) у трех здоровых подконтрольных. (B) Проценты экспрессии активационных маркеров в состоянии покоя, MGN-3/Биобран- и IL-15-стимулированные NK-клетки.
Исследования цитотоксичности In vitro
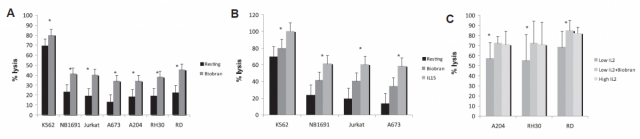
Рисунок 3. (A) Цитотоксическая активность MGN-3-стимулированных NK-клеток в отношении клеточных линий K562, NB1691, Jurkat и A673 (эффектор/мишень 8:1), A-204, RD и RH-30 (эффектор/цель 10:1). (B) IL-15 и цитотоксическая активность MGN-3-стимулированных NK-клеток в отношении клеточных линий K562, NB1691, Jurkat и A673 (эффектор/мишень 8:1). (C) IL-2- и цитотоксическая
активность MGN-3-стимулированных NK-клеток против A-204, RD и RH-30 (эффектор/мишень 10:1). Данные включают результаты от 3-х здоровых волонтеров
в 3 независимых экспериментах.
Стимуляция с помощью MGN-3/Биобран повлекла за собой значительное увеличение цитотоксичности NK-клеток по сравнению со всеми протестированными клеточными линиями при коэффициенте E/T 8:1 (K562, NB1691, Jurkat, A673) или 10:1 (A-204, RD, RH-30) в сравнении с нестимулированными NK-клетками в покое (Рис. 3A, K562 80% против 69%, P ј 0.03, NB1691 41% против 23%, P ј 0.03, Jurkat 40% против 19%, P ј 0.03, A673 34% против 13%, P ј 0.02, A204 34% vs. 18%, P ј 0.03, RD 45% против 22%, P ј 0.002, RH-30 34% против 18%, P ј 0.02). Стимуляция с помощью IL-15 привела к даже более высоким процентам лизиса клеточных линий K562 (100%), NB1691 (61%), Jurkat (60%) и A673 (58%) (Рис. 3B). Чтобы протестировать синергический эффект IL-2 и MGN-3/Биобран, мы сравнили стимуляцию с помощью высокой дозировки IL-2 (1000 IU/мл) с помощью низкой дозировки IL-2 (40 IU/мл) и низкой дозировки IL-2 ю MGN-3/Биобран.
Добавление MGN-3/Биобран к низкой дозировке IL-2 увеличило стимулирующий эффект 40 IU/мл IL-2 и повлекло за собой цитотоксичность, сравнимую с той, что была получена с помощью 1000 IU/мл IL-2 (Рис. 3C). Чтобы протестировать профиль безопасности MGN-3/Биобран-стимулированных NK-клеток, мы провели исследования цитотоксичности по негативным контролям (автологичные негативные клетки CD56), которые показали отсутствие цитотоксичности (дополнительный Рис. 2 и дополнительная Таблица I для обозревателей)
Модель in vivo
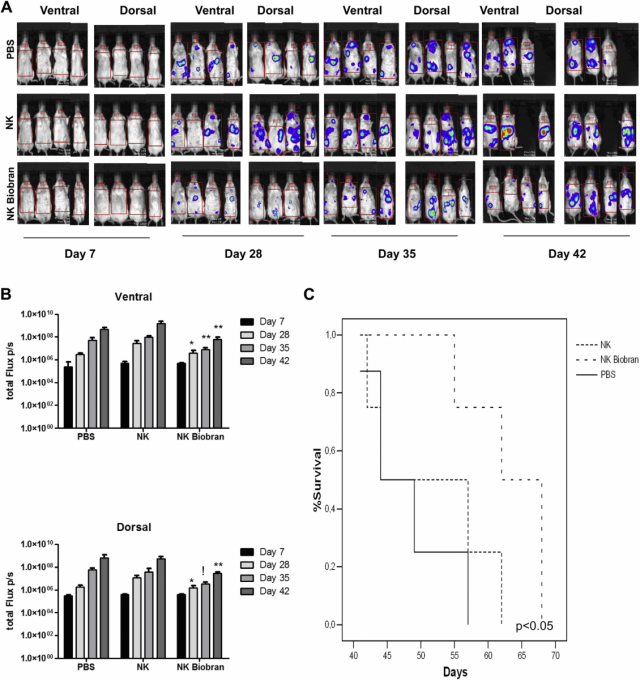
Рисунок 4. (A) Снимки NB1691 опухолей, экспрессирующих люциферазы, иллюстрируют нагрузку нейробластомы у мышей, получающих PBS (контрольная группа), 1 x 106 свежеизолированные простимулированные NK-клетки и 1 x 106 MGN-3-стимулированные NK-клетки (вводились с помощью 8 внутривенных инъекций, дважды в неделю в течение 4 последующих недель). Показаны снимки трех представителей-мышей, брюшные и спинные, из каждой группы. ROI, область интереса. (B) Объем сжатия опухоли, имеющий отношение к значениям базовой линии, был значительно выше у группы мышей, которая получала MGN-3-стимулированные NK-клетки, чем в контрольной группе либо в группе, которая получала обычные NK-клетки. (C) Кривые Каплана-Мейера указывают выживаемость каждой группы мышей. !Статистически значимая по сравнению с каждой контрольной группой. *Статистически значимая по сравнению с группой, не простимулированной NK-клетками. **Статистически значимая по сравнению с обеими группами.
Чтобы исследовать, имеет ли стимулирующее влияние MGN-3/Биобрана на NK-клетки in vitro клиническое значение, мы расширили наше исследование до ксенографической модели люциферазы-трансфектированной нейробластомы in vivo. Рис. 4A показывает вентральные и задние био-снимки 3 представителей мышей, получающих PBS (контроль), нестимулированные NK-клетки (1 x 106 )и MGN-3/Биобран-стимулированные NK-клетки (1 x 106 ). Наблюдалась резкая прогрессия опухолей NB1691 в контрольной группе и группе, получающей нестимулированные NK-клетки, в то время как подавление значительного роста нейробластомы наблюдалась в группе, которая получала MGN-3/Биобран-стимулированные NK-клетки(1 x 106 ) (Рис. 4B и дополнительная Таблица II для обозревателей). Мы также обнаружили, что MGN-3Биобран-стимулированные NK-клетки значительно повышали выживаемость в модели NOD/scid/IL- 2Rgnull-hu (P < 0.05; Рис. 4C).
Роль MGN-3/Биобран в расширении NK-клеток
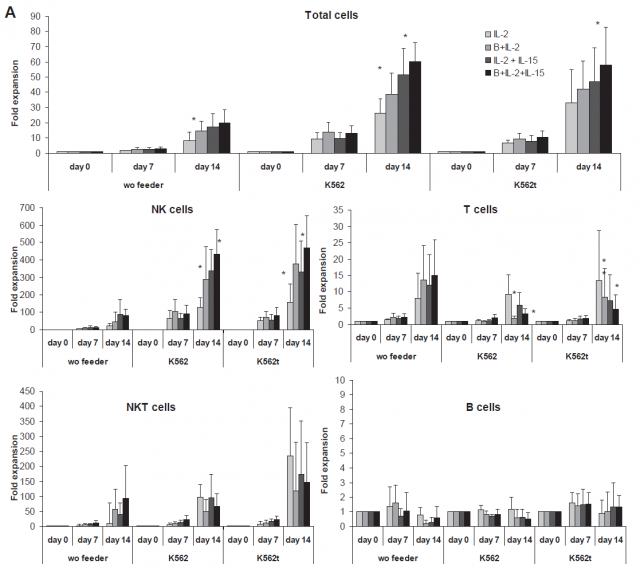
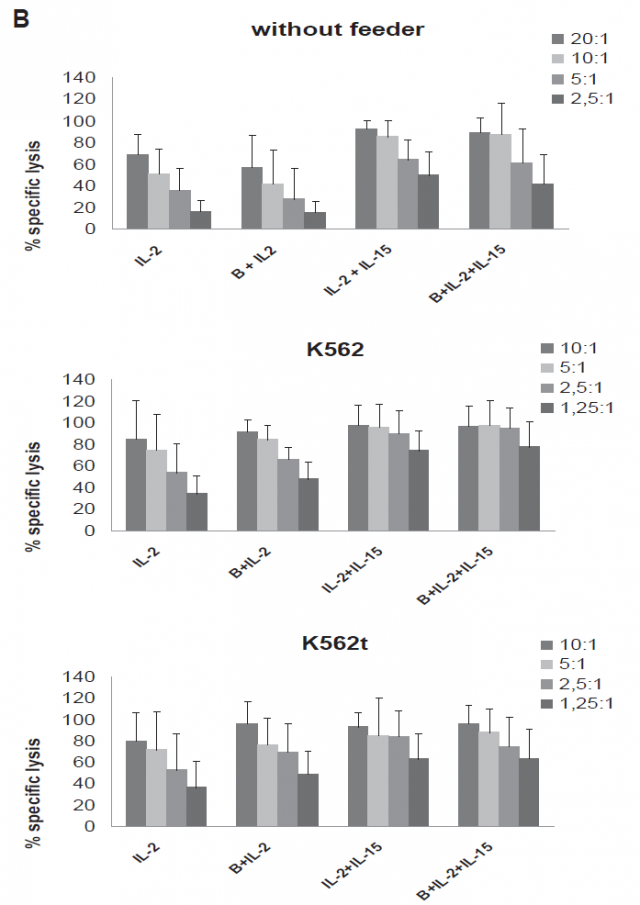
Рисунок 5. (A) Кинетика общих клеток, NK-клеток, T-клеток, NKT-клеток и B-клеток через 14 дней расширенного культивирования от 5 здоровых доноров с MGN-3/Биобрана и цитокинов (IL-2 или IL-2 ю IL-15) и без него (wo) или со-культивирования с помощью облученных питающих клеток, состоящих из клеточных линий K562 или K562-mb15-41BBL. *Статистически значимая. (B) Цитотоксическая активность расширенных NK-клеток с добавлением MGN-3/Биобран в питательную среду.
После 2 недель культивирования NK-клетки увеличились значительнее при добавлении MGN-3/Биобран добавлен в питательную среду (дополнительная Таблица III). В то же время при добавлении MGN-3/Биобран был добавлен в питательную среду увеличение T-клеток было снижено. Добавление MGN-3/Биобран к IL-2 и IL-2 к IL-15 культур не произвело статистически значительного различия в NKT-клетках и B-клетках. Цитотоксическая активность увеличенных NK-клеток значительно не изменилась, когда MGN-3/Биобран был добавлен в питательную среду (Рис. 5B). Для сравнения, добавление IL-15 привело к увеличеннию цитотоксичности в сравнении только с IL-2, даже при использовании трансфектированной клеточной линии K562.
Механизмы MGN-3/Биобран стимуляции на NK-клетки
В связи с тем, что NK-клетки человека могут быть стимулированы с помощью TLR, мы протестировали TLR-антигенную стимуляцию MGN-3/Биобраном с использованием человеческих макрофагов в качестве биосенсоров для определения оптимальной дозы MGN-3/Биобран для стимуляции NK-клеток без стимуляции макрофагов. Только высокий уровень MGN-3/Биобран (10 мг/мл) повлек за собой производство IL-8, IL-6 и TNF-a (4776, 164 и 132 и пг/мл, соответственно), смотрите Рис. 1. Данные измерения были значительно ниже тех, которые наблюдались с помощью LPS (10 нг/мл) стимулирования (7487, 362 и 208 пг/мл, соответственно).
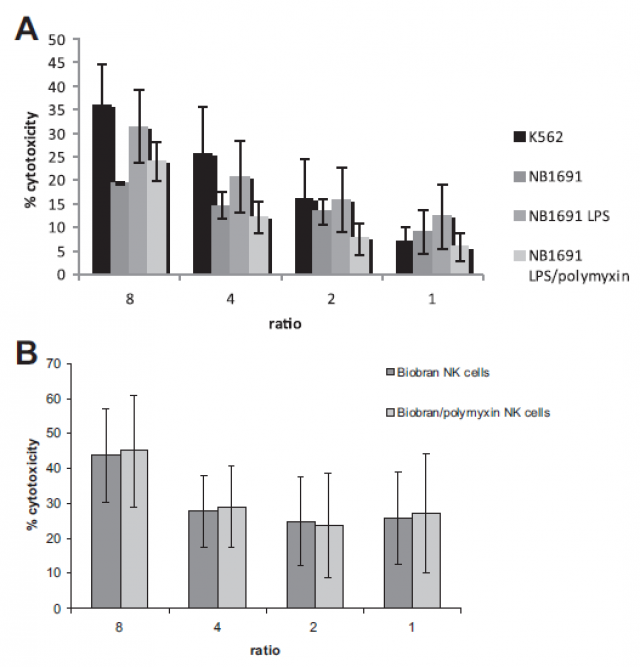
Рисунок 6. (A) LPS-стимулированные NK-клетки повышают цитотоксичность NK-клеток в состоянии покоя в отношении NB1691, а добавление полимиксина B, отменяет LPS стимуляцию в состоянии покоя. (B) MGN-3/Биобран стимулирует NK-клетки в отношении NB1691, с которыми не вступает в противодействие полимиксин B.
Мы наблюдали следы (Eu/мл ј 1.68) содеражния LPS в MGN-3 Биобран в исследовании лизата амёбоцитов мечехвоста (ЛАМ). Чтобы исследовать роль содержания LPS MGN-3/Биобрана в качетсве механизма стимулирования, мы in vitro провели анализ цитотоксичности в отношении NB1691. Эти исследования показали повышенную цитотоксическую активность LPS-стимулированных NK-клеток в сравнении с NK-клетками в состоянии покоя, в то время как полимиксин B снизил влияние LPS стимулирования (Рис. 6A). Для сравнения, стимулирующий эффект MGN-3/Биобран на NK-активность в отношении NB1691 не мог быть антагонизирован с полимиксином B (Рис. 6B). Механизм NK-стимулирования не опосредуется LPS-содержанием в MGN-3/Биобран.
Дискуссия
Опубликованные исследования показали, что использование MGN- 3/Биобран в терапии рака может улучшить результаты у некоторых онкологических пациентов. Клиническое исследование взрослых пациентов с гепатоцеллюлярной карциномой показало, что дабвление MGN-3/Биобран в интервенциональные терапии, включая трансартериальную хемоэмболизацию, чрескожную инъекцию этанола, радиочастотную абляцию и криоабляцию улучшило общую выживаемость. Также было замечено повышение MGN-3 стимулированного внутреннего иммунитета у пациентов с меиломной болезнью за счет увеличения цитотоксической активности NK-клеток, уровней миелоидных DC и концентраций клеток T-помощников типа l-связанных цитокинов. Нет отчетных данных касательно использования MGN-3/Биобран с детскими опухолями.
Наше исследование показывает, что стимулирование NK-клеток с помощью MGN-3/Биобран воысило цитотоксическую активность как in vitro, так и in vivo против различных опухолевых клеточных линий детских опухолей. Мы продемонстрировали повышенный клеточный цитолиз NK-клеток клеточных линий острого лейкоза, нейробластомы, саркомы Юинга, эмбрионической рабдомиосаркомы и альвеолярной рабдомиосаркомы in vitro после стимулирования с помощью MGN-3/Биобран. Мы также наблюдали значительное подавление роста нейробластомы и значительное увеличение выживаемости у животных с моделью нейробластомы NOD/scid/IL-2Rgnull при использовании MGN-3/Биобран-стимулированных NK-клеток. Эти данные согласуются с предыдущими данными, опубликованными по злокачественных образованиям у взрослых. Механизмы и доза, с помощью которых MGN-3/Биобран повышает активность NK-клеток, остаются неизвестными. Мы полагаем, что различные иммунные механизмы могут быть вовлечены в благотворное влияние, наблюдаемое на фоне лечения NK-клетками, стимулированными MGN-3/Биобраном. В связи с тем, что большие дозировки MGN-3/Биобрана повлекли за собой модификацию макрофагов от M0 до M1, производящего IL-6, IL-8 и TNF-a, мы посчитали, что низкие дозы MGN-3/Биобран убирают активацию NK-клеток, вызванную воспалительным фоном. В связи с тем, что антогонисты TLR могут стимулировать NK-клетки, мы выдвинули гипотезу о том, что содержание LPS в MGN-3/Биобран могло увеличить цитотоксичность NK-клеток по TLR-4-сигналу. В нашем исследовании наблюдалось небольшое количество содержания LPS. Однако вследствие того, что нейтрализация LPS с помощью полимиксина B не отменила стимулирующий эффект MGN-3/Биобран на активность NK-клеток, мы полагаем, что содержание LPS не является механизмом, посредством которого MGN-3/Биобран стимулирует NK-клетки. Согласно нашим данным, MGN-3/Биобран активирует NK-клетки в состоянии покоя, однако, он не в состоянии далее активировать клетки, обработанные IL-15, несмотря на увеличение их экспансии на протяжении этого периода.
Дополнительно, использование MGN-3/Биобран в комбинации с низкодозированным IL-2 повысило цитотоксическую активность NK-клеток до того же уровня, что и высокая дозировка IL-2. Эти данные нахоядтся в соответствии с более ранними исследованиями. Таким образом, MGN-3/Биобран и низкая дозировка IL-2 действуют синергически, и это может способствовать избежать токсического действия при лечении большими дозировками IL-2 in vivo.
Данные исследований здоровых пациентов предложили, что использование MGN-3/Биобран в качестве альтернативыного или адъювантного лечения с различным иммунотерапевтическим подоходом может оказать пользу при терапии злокачественных новообразований. Наши результаты распространяются на педиатрических пациентов вследствие отмеченного увеличения цитотоксической активности NK-клеток с добавлением MGN-3/Biobran в отношении множества педатрических опухолей in vitro и нейробластомы in vivo. Мы также наблюдали, что добавление MGN-3/Биобран повышало экспансию/активацию NK-клеток и в комбинации с низкой дозировкой IL-2, имело благоприятный эффект на активацию NK-клеток с целью иммунотерапии нейробластомы. Оправданы дальнейшие исследования в условиях клинической педиатрии для изучения роли MGN-3/Биобран в комбинации с химио-имунными протоколами.
Данный результат позволяет предположить механизм частичного перекрытия действия с IL-15. Другая теория заключается в апоптотическом эффекте, опосредованном активацией NK-клеток, вырабатывающими TNF-a и IFN-g. Данная теория поддерживается недавно приведенными данными о том, что добавление MGN-3/Биобран в курс химиотерапии имело синергетический эффект. Это показано улучшенным апоптозом и подавлением пролиферации опухолевых клеток у пациентов с раком молочной железы. Иным возможным механизмом могло бы быть увеличение активирующих рецепторов NK-клеток, стимулированных с помощью MGN-3/Биобрана. Мы наблюдали ассоциированное с активацией увеличение рецепторов CD69 и CD25 на MGN-3/Биобран-стимулированных NK-клетках здоровых доноров. Высокий уровень CD69 на NK-клетках корреллирует с увеличением цитотоксичности NK-клеток. Кроме того, пролиферативный потенциал усиливается при усилении экспрессии CD25 на NK-клетки. Наконец, о взаимодействие MGN-3/Биобрана с иными иммунными клетками также сообщалось.
Адоптивный трансфер in vitro активированных NK-клеток на данный момент используется для терапии рака. Недавние исследования продемонстрировали, что NK-клетки можно расширить до большого количества ex vivo, используя различные методы, включая применение K562-mb15-41BBL в качестве питающих клеток. Это увеличивает активность NK-клеток in vitro на множество клеточных линий и злокачественных новообразований, включая и детские раковые опухоли. Когда мы добавили MGN-3/Биобран в различные протоколы экспансии, мы наблюдали увеличение экспансии NK-клеток, задержку цитотоксической активности и сокращение количества T-клеток. Эти данные могут быть важными для масштабного расширения высоко цитотоксического лечебного класса NK-клеток, особенно в аллогенной форме, когда T клетки должны быть удалены, чтобы избежать реакции ТПХ «трансплантат против хозяина».
06 Март 2015
06 Март 2015


