Противоопухолевый эффект BioBran у мышей с опухолью Эрлиха
Н. В. Эль-Дин, Э. Ноаман, М. Гонеум
Аннотация
Данное исследование проводилось с целью изучения в естественных условиях противоопухолевого действия BioBran, модифицированного арабиноксилана получаемого из экстракта рисовых отрубей. Для исследования использовались швейцарские мыши-альбиносы, которым была сделана внутримышечная инъекция в правое бедро клеток асцитной карциномы Эрлиха. На 8 день мыши с солидной карциномой Эрлиха получили внутрибрюшную инъекцию с BioBran. После этого изучался рост опухоли, производство цитокина и апоптотическое действие BioBran. В результате исследования оказалось, что BioBran вызвал значительную задержку объема опухоли (63.27%) и веса опухоли (45.2%), по сравнению с контрольными особями (P<0.01). Механизмы, за счет которых BioBran оказывает противоопухолевое действие, по всей вероятности, связаны со способностью препарата индуцировать апоптоз, а также с иммуномодулирующими свойствами препарата. BioBran вызвал увеличение апоптотических клеток солидной карциномы Эрлиха на 1.8 процентов, что было определено проточной цитометрией и гистопатологическим исследованием. Более того, BioBran оказал влияние на производство плазменного цитокина, повысив уровни фактора некроза опухоли-альфа и интерферона–гамма, одновременно снижая уровень содержания иммуноподавляющего цитокина интерлейкина-10. Данные также показали, что у мышей, у которых не было обнаружено опухоли, после внутримышечного введения BioBran в два раза увеличилась деятельность естественных киллеров. Не было отмечено никаких побочных эффектов после лечения препаратом BioBran. Все животные показали нормальную модель питания\питья и жизненную активность. Полученные данные могут иметь клинические предпосылки для лечения солидного типа рака.
Введение
Рак остается самой главной причиной смертности во всем мире. Каждый год умирает порядка 6 миллионов человек. Противораковые препараты вызывают апоптоз клеток рака, но такое лечение крайне токсично, оно подавляет иммунитет, носит мутагенный и карциногенный характер. Предыдущие исследования показали, что несколько природных агентов обладают противораковым действием, включая производные имбиря (6), Allium sativum (чеснок) (7,8), витамин Е (9), китайский сбор трав (PC-SPES) (10), полисахарид К, связанный с белком (11) и дрожжи (12-14). Данное исследование служит для введения BioBran в эту группу противораковых агентов. BioBran – это арабиноксилан, полученный из экстракта рисовых отрубей с помощью энзимов гриба шиитаке. Предыдущие результаты показали, что BioBran является потенциальным модификатором биологического ответа (МБО), который стимулирует сразу несколько разных областей иммунной системы, включая NK-клетки (естественные киллеры), Т-клетки, В-клетки и макрофаги. Кроме того, BioBran способен сенсибилизировать CD95 рецепторы клеточной поверхности лейкемических клеток, которые участвуют в запуске апоптоза. В данном исследовании мы изучали в естественных условиях противоопухолевое действие BioBran и его влияние на производство цитокина и деятельность NK-клеток. Данные исследования показали, что и внутрибрюшные и внутриопухолевые инъекции агента BioBran мышам привели к значительному сокращению объема опухоли. Механизмы, которые отвечают за этот феномен могут быть связаны с иммуномодулирующими и апоптическими функциями этого продукта. Полученные данные могут стать предпосылкой для клинического применения BioBran при лечении солидных опухолей.
Материалы и методы
Животные
Самки швейцарских мышей-альбиносов (2 месяца) весом от 19 до 21г были помещены в 5 клеток, где поддерживалась постоянная температура 24°С ± 2°С с поочередными циклами дневного света и темноты. Животным был обеспечен стандартный гранулированный корм и вода без ограничения количества. Гранулы корма содержали казеин (12.5%), жиры (1.0%), пшеничную муку (80%), отруби (3.3%), оливковое масло (2.3%), ДЛ-метионин (0.5%), смесь витаминов и соли (0.2%) и воду (0.2%). Пропорции по суммарному числу калорий составили: 18% белки, 73% углеводы, 9% жиры. Гранулированный корм закупался у компании Misr Oil & Soap Company (Каир, Египет). Отслеживалось фактическое потребление корма. Было выявлено, что потребление корма составило 4-5 г в день при весе животного 20 г ± 2 г.
Опухолевые линии клеток
В этом исследовании были использованы две опухолевые клеточные линии. Клетки карциномы Эрлиха, которые были любезно предоставлены Национальным Институтом Рака, Университет Каира, Египет, поддерживались еженедельной внутрибрюшинной трансплантацией клеток 2.5 х 106. Клеточная линия искусственной хромосомы дрожжей - 1 (YAC-1) (вирус мышиного Т-клеточного лейкоза Молони мышей линии A/Sn) была получена из Американской коллекции типовых культур (ATCC, Роквиль, Мэриленд) для оценки активности NK-клеток.
Полная среда
Для поддержания роста клеток использовалась среда RPMI-1640 с 10% термоинактивированной эмбриональной телячьей сывороткой, 2 молями глютамина и 100 µг\мл стрептомицина и пенициллина.
BioBran – это переработанная гемицеллюлоза, которую получают путем реакции гемицеллюлозы рисовых отрубей с множеством гидролизирующих углеводных ферментов грибов шиитаке. Основная химическая структура BioBran – это арабиноксилан, в основной цепи содержится ксилоза, в составе боковой цепи – арабиноз. Агент содержит полисахариды (ß1, 3-глюкан и активированная гемицеллюлоза). Для обеспечения чистоты и постоянства продукта BioBran в каждой партии, было измерено 9 параметров, каждый по конкретному методу и спецификации (Таблица 1). Кроме того, для определения эффективной фракции BioBran в исходном виде применялся стандартный тест на реакцию с антроном. В текущем исследовании BioBran был растворен в 0.9% солевого раствора и вводился мышам с солидной карциномой Эрлиха посредством внутрибрюшной или внутриопухолевой инъекции (40 мг\кг веса). BioBran был предоставлен компанией Daiwa Pharmaceuticals Co., Ltd, Токио, Япония.
Таблица 1
Анализ препарата BioBran в каждой партии
|
Параметр |
Метод тестирования |
Спецификация |
|
Внешний вид
Влажность Протеин Зола
Углеводы Мышьяк (As2O3)
Тяжелые металлы (свинец)
Число аэробных бактерий
Коликоподобные бактерии
|
Органолептический тест
Потеря при сушке Метод Фолина-Чикальтеу Метод определения зольности на сухую массу Тест на реакцию с антроном Метод применения диэтилдитиокарбамата серебра Проверка по ограничению тяжелых металлов Стандартный чашечный метод подсчёта Способность образовывать газ - лактозный бульон с бриллиантовой зеленью |
Светло-коричневый порошок < 8.0 8.0~15.0% 5.0~10.0%
65.0~80.0% <5.0 мг/дм3
< 20.0 мг/дм3
< 3.0 х 103 КОЕ*/г
Негативная |
*КОЕ - Колониеобразующая единица
План эксперимента
Трансплантация опухоли, внутрибрюшная и внутриопухолевая инъекции BioBran.
На день 0, самкам швейцарских мышей-альбиносов было внутримышечно введено 0.2 мл клеток асцитной карциномы Эрлиха (клетки 2.5 х 106) в правое бедро задней конечности. Мыши с солидной опухолью Эрлиха массой ~ 100 мм3 были распределены по двум группам в случайном порядке для внутрибрюшного лечения: 1) мыши с солидными опухолями получали внутрибрюшные инъекции буферного раствора фосфата (PBS; n = 13) 2) мыши с солидными опухолями получали внутрибрюшные инъекции BioBran (n = 13). Аналогично, мыши, которые получали внутриопухолевое лечение были в случайном порядке разделены на две группы: 1) мыши, получавшие внутриопухолевые инъекции буферного раствора фосфата (n = 10) 2) мыши, получавшие внутриопухолевые инъекции BioBran (n = 10). В каждом эксперименте участвовала контрольная группа мышей без опухоли (n = 8) для установления базовой планки для всех параметров, попадающих под данное исследование. Доза BioBran была 40 мг\кг веса в одной инъекции 0.1 мл. Животные получавшие лечение посредством внутрибрюшных инъекций начали лечение на 8 день после введения клеток асцитной карциномы Эрлиха, лечение продолжалось в течение 3 недель 3 раза в неделю. Животные, получавшие лечение посредством внутриопухолевых инъекций начали лечение на 11 день после ввода клеток асцитной карциномы Эрлиха, лечение продолжалось в течение 5 недель 2 раза в неделю.
Анализ объема опухоли и вес опухоли.
Измерения временных интервалов объема опухоли при помощи цифровых калиперов проводились с 8 по 35 дни или с 11 по 45 дни после введения клеток асцитной карциномы Эрлиха. Собранные данные были применены к следующей формуле, чтобы получить значение объема опухоли: Объем опухоли (мм3) = 0.52 АВ2, где А – это малая ось, а В – основная ось. На 35 день после получения внутрибрюшных инъекций препарата BioBran, мыши подверглись эвтаназии, опухоли были вырезаны для определения их веса. Были сделаны фотографии для определения регрессии опухоли и проведения гистопатологических исследований.
Изменения веса тела
Животные с солидной карциномой Эрлиха, получавшие лечение посредством внутрибрюшных инъекций препаратом BioBran или буферным раствором фосфата наблюдались на предмет изменений массы тела: (начальная масса тела замерялась на 0 день, а конечный чистый вес замерялся на 35 день). Чистый конечный вес = (конечный вес – вес опухоли). Прибавление веса тела определялось, как разница между начальным весом тела и чистым конечным весом тела.
Апоптоз определяемый проточной цитометрией
Проточная цитометрия применялась для измерения процента апоптотических опухолевых клеток у мышей с опухолью, которые получали лечение внтурибрюшной инъекцией либо буферным раствором фосфата, либо BioBran. Мертвые клетки были выявлены при помощи флуоресцеин-конъюгированного аннексина V и иодида пропидия (набор для выявления апоптоза Annexin V-FITC, BioVision Research Products, Маунтин-Вью, Калифорния). Клеточные суспензии были подготовлены по методу, описанному в исследовании Трибукайта и коллег. Клетки были получены с использованием аппарата FACSCAN (Компания Becton-Dickinson, Сан-Хосе, Калифорния) и проведен анализ при помощи программного обеспечения Cell-Quest.
Гистопатологические исследования. Гистопатологические исследования проводились с целью оценить цифры апоптоза у мышей с опухолью, которые получали лечение посредством внутрибрюшной инъекции препаратом BioBran или буферным раствором фосфата. Опухолевые ткани были помещены в 10% нейтральный формалиновый буфер на минимальное количество времени - 24 часа, парафиновые срезы опухоли были обработаны (толщина 4 µm) и окрашены гематоксилином и эозином. Срезы оценивались на предмет апоптотических изменений под оптическим микроскопом.
Анализ цитокинов
На 35 день после введения опухолевых клеток была собрана плазма у трех групп животных: мыши без опухоли (контрольная группа), мыши с опухолью и методом лечения при помощи PBS (буферный раствор фосфата) и мыши с опухолью и методом лечения посредством внутрибрюшных инъекций BioBran. За 16 часов перед забором образца мыши ничего не ели. Плазма применялась для оценки уровней фактора некроза опухоли-альфа, интерферона–гамма и интерлейкина 10 (ИЛ-10). Концентрации цитокина у мышей измерялись посредством наборов для иммуноферментного анализа с флуоресцентным усилением, предоставленного компанией CytImmune Sciences Inc. (Роквтль, Мэриленд).
Изучение NК-клеток
Подготовка селезеночных клеток. Мыши без опухоли получали ежедневную инъекцию препарата BioBran (100 µг\мл) в бедро. После периода лечения в течение 14 дней мыши были выведены из эксперимента путем смещения шейных позвонков. Была удалена селезенка, помещена в полную среду и заражённые эритроциты были лизированы в дистиллированной воде в течение 20 секунд при комнатной температуре (27°С). Суспензии отдельных клеток были промыты один раз в сбалансированном солевом растворе Хенкса, затем клетки были перерастворены в концентрации 1 х 107 клеток\мл в полной среде. Подсчет клеток проводился при помощи гемоцитометра и оптического микроскопа.
Измерение активности NK-клеток посредством микроцитотоксического теста с радиоактивным хромом. Стандартное определение активности NK-клеток посредством микроцитотоксического теста с радиоактивным хромом применялось следующим образом: опухолевые клетки-мишени YAC-1 (5 х 106) были помечены раствором хромата натрия (100 µCi) на 1 час в 0.1 мл полной среды. Далее опухолевые клетки были промыты 4 раза в 5 мл сбалансированного солевого раствора Хенкса и 1 х 104 клетки были пипеткой перенесены в 96-луночный планшет с круглым дном Linbro (Linbro Chemical Co., Хамден, Коннектикут). Клетки-эффекторы были помещены в лунки в четырех экземплярах, чтобы получить соотношение эффектор:мишень (Э:М) 100:1, 50:1, и 12.5:1. После 4 часовой инкубации при температуру 37°С, из каждой лунки было собрано 0.1 мл надосадочной жидкости и ее поместили в гамма-счетчик. Процент освобожденного изотопа вычислялся по следующей формуле:

Где Спонт. означает спонтанное, а эксп. – экспериментальное высвобождение. Кривая зависимости «доза-эффект» для клеточных населений была получена за счет определения процентного соотношения клеток-мишеней, погибших по оси y и соотношения Э:М по оси x. Далее были определены единицы лизиса, как число клеток-эффекторов, экстраполированных из кривой зависимости «доза-эффект», где 1 единица лизиса соответствует числу клеток-эффекторов, необходимых для достижения 15% лизиса. Единица лизиса\1х107 – это число единиц лизиса в 10 миллионах клеток-эффекторов.
Оценка мишень-эффекторного конъюгата. Способность селезеночных NK-клеток эффекторов образовывать конъюгаты с YAC-1 клетками-мишенями измерялась в обеих группах (BioBran и контрольной группе). Клетки селезенки (1х105) были инкубированы с клетками-мишенями 5х105 в 1мл полной среды. Смесь клеток была осаждена центрифугированием при 130г в течение 10 минут и инкубирована на 1 час при температуре 4°С. Клеточные осадки были ресуспензированы, центрифугированные мазки подготовлены и окрашены по Гимзе. Процент конъюгатов определялся после подсчета 200 лимфоцитов (связанных и свободных) в образцах по три экземпляра.
Побочные эффекты BioBran (Токсичность)
Каждый день мышей проверяли на предмет побочных эффектов BioBran. В течение всего периода лечения изучались отклонения от нормальных циклов питания\питья и жизненной активности. Изменения массы тела также фиксировались каждую неделю.
Статистический анализ
Значения цитокина рассматривались, как среднее ± стандартная ошибка среднего. Данные анализировались при помощи однофакторного дисперсионного анализа, за которым следовал анализ post hoc множественности сравнений. Статистическая значимость других данных определялась по критерию Стьюдента. Различия рассматривались, как значимые при уровне P < 0.05.
Результаты
Побочные эффекты BioBran (Токсичность)
Над животными велось наблюдение на предмет возникновения потенциальных токсичных побочных эффектов при лечении BioBran. Не было выявлено никаких побочных эффектов или неумышленного летального исхода во время периода лечения (35 дней). Кроме того, мыши в группе, получавшие лечение внутрибрюшными инъекциями препарата BioBran показали значительную прибавку массы тела в конце периода лечения.
Объем опухоли
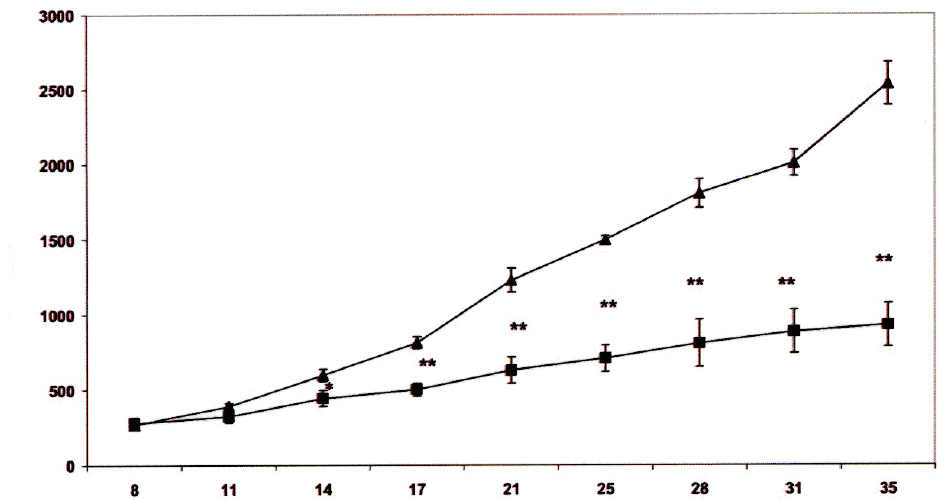
Внутрибрюшная инъекция BioBran. На рисунке 1А показано, что внутрибрюшное введение BioBran мышам с опухолью привело к замедлению развития солидной опухоли, что стало статистически значимо уже на 14 день после лечения. На день 35 процент различий в объеме опухоли у мышей в группе BioBran (931.98 мм3 ± 144.76) и в группе PBS (буферный раствор фосфата) (2537.11мм3 ± 143.52) достиг – 63.27% (P<0.01). Изображения опухоли мышей из группы BioBran явно демонстрируют значительную регрессию опухоли по сравнению с мышами в группе PBS. Аналогичные уровни регрессии опухоли наблюдались во всех тестируемых группах (Рисунок 1В).
Дни после лечения
(а)
Рис. 1. А: Эффект внутрибрюшной инъекции BioBran на объем опухоли в естественных условиях. Мышам в правое бедро были введены клетки асцитной карциномы Эрлиха. На 8 день после введения опухолевых клеток, мыши с солидной карциномой Эрлиха получили инъекции препарата BioBran(■) и, далее, изучался объем опухоли мм3 на 8 день и до 35 дня. Цифры представляют изменения в объеме опухоли мм3 в ходе лечения. Затем результаты сравнивались с группой мышей с опухолью, получавшие лечение PBS(▲). Каждое значение представляет среднее ± стандартная ошибка среднего. * Р<0.05, ** Р<0.01 в сравнении с группой PBS в соответствующий период времени.
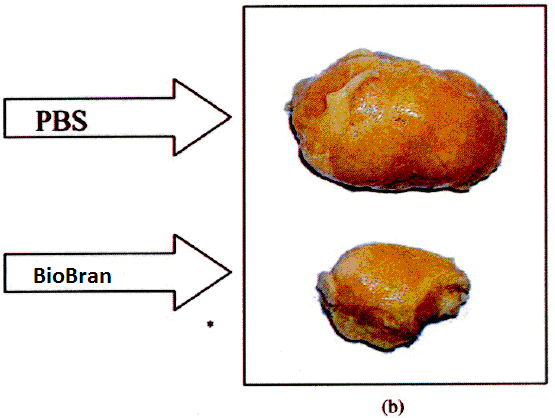
Рис. 1. Б: Изображение регрессии опухоли у мышей с опухолью в группе BioBran и группе PBS. Данные являются репрезентативными для всех исследуемых групп.
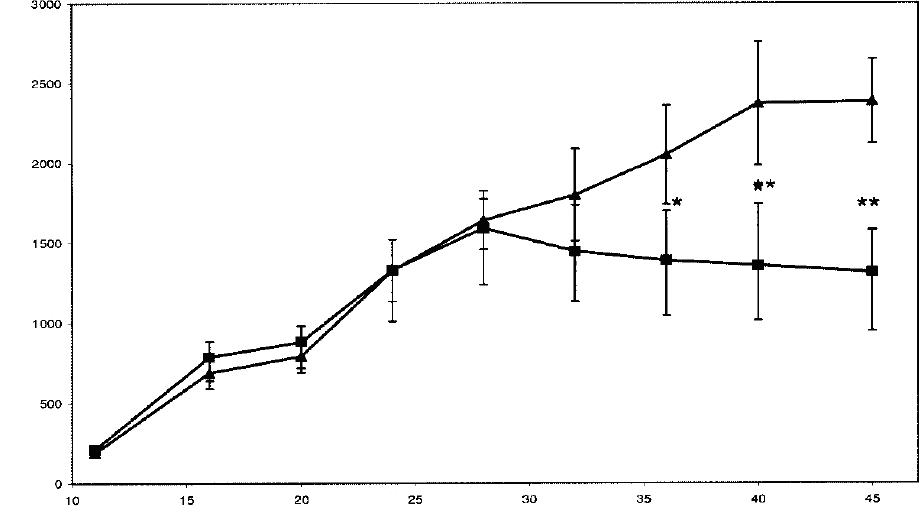
Внутриопухолевая инъекция BioBran. Задачей внутриопухолевой инъекции было изучение альтернативного способа, при помощи которого BioBran может проявить свое противоопухолевое действие в естественных условиях. Рисунок 2 показывает, что внутриопухолевое введение BioBran подавило рост опухоли, что проявилось на 28 день после лечения. Различия в объеме опухоли стали статистически значимыми на 36 день, когда задержка в росте опухоли достигла – 32.24%, P<0.05. Различия в объеме опухоли стали статистически значимыми, когда процентное отклонение между мышами с опухолью в группе BioBran и группе PBS достигло – 44.83%, P<0.01 на 45 день введения опухолевых клеток.
Дни после лечения
Рис. 2. Эффект внутриопухолевой инъекции BioBran на объем опухоли в естественных условиях. Мышам в правое бедро были введены клетки асцитной карциномы Эрлиха. На 11 день после введения опухолевых клеток, мыши с солидной карциномой Эрлиха получали инъекции препарата BioBran 2 раза в неделю в течение 5 недель в концентрации 40 мг\кг веса тела (■). С 11 дня и до 45 дня изучался общий объем мм3, результаты сравнивались с группой мышей с опухолью, получавшие лечение PBS (▲). Каждое значение представляет среднее ± стандартная ошибка среднего. *Р<0.05, **Р<0.01 в сравнении с группой PBS в соответствующий период времени.
Вес опухоли
В Таблице 2 показан эффект внутрибрюшного лечения препаратом BioBran на вес опухоли, которая исследовалась по окончании эксперимента на 35 день. Вес опухоли у мышей в группе PBS составил 6.62 ± 0.38г. С другой стороны, вес опухоли у мышей в группе BioBran составил 3.63 ± 0.45г, что представляет статистически значимые изменения (P<0.01) в весе опухоли. Разница в процентах составила 45.2%.
Таблица 2
Влияние внутрибрюшной инъекции BioBran на вес тела (г) и вес опухоли (г)
|
Группа Параметры |
Мыши с опухолью |
||
|
|
PBS |
BioBran |
|
|
Начальный вес тела (г) (день 0) Среднее ± ошибка среднего № мыши Конечный вес тела (г) (день 35) Среднее ± ошибка среднего № мыши Вес опухоли (г) (день 35) Среднее ± ошибка среднего Чистый конечный вес тела (г) Среднее ± ошибка среднего Прибавка веса тела (г) % от начального веса тела |
20.21 ± 0.47 13/13
26.67 ± 0.58 11\13
6.62 ± 0.38
20.05 ± 0.48 - 0.15 г (- 0.79%) |
|
20.64 ± 0.51 13\13
25.78 ± 0.54 13\13
3.63 ± 0.45b
22.15 ± 0.63с + 1.51 г (+ 7.32%) |
- Каждое значение представляет среднее ± стандартную ошибку среднего соответствующего числа животных\групп. Чистый конечный вес тела = (Конечный вес тела на 35 день – вес опухоли на 35 день). Прибавка веса тела (Чистый конечный вес тела – начальный вес тела).
- Статистически значимо при Р<0.01 в сравнении с группой PBS.
- Статистически значимо при Р<0.0025 в сравнении с начальным весом тела.
Вес тела
Изменения в весе тела изучались в течение 35 дней проведения эксперимента. Как показано в Таблице 2, внутрибрюшное введение BioBran мышам с солидной карциномой Эрлиха вызвало значительную прибавку массы тела + 7.32%, P<0.025.
Апоптоз солидной карциномы Эрлиха
Проточная цитометрия. Данные в Таблице 3 показывают анализ проточной цитометрии процентного числа апоптических клеток у мышей с солидной карциномой Эрлиха на 35 день после трансплантации клеток. У мышей с опухолью в группе лечения PBS были выявлены апоптические клетки 42.61 ± 5.56%. Внутрибрюшное лечение BioBran значительно повысило процент апоптотических клеток (74.68 ± 4.22%). Это говорит об увеличении процентного числа апоптотических клеток солидной карциномы Эрлиха в 1.8 раз (Р<0.0001).
Таблица 3
Влияние внутрибрюшной инъекции BioBran на процент апоптотических опухолевых клеток у мышей с солидной карциномой Эрлиха, по показаниям проточной цитометрии на 35 день после введения клеток
|
Группа Параметры |
Мыши с опухолью |
||
|
|
PBS |
BioBran |
|
|
% Апоптотических опухолевых клеток Среднее ± ошибка среднего % изменений от контрольных показаний Статистическая значимость № мыши |
42.61 ± 5.56% - % - % 8 |
|
74.68 ± 4.22% 75.26% Р < 0.0001 8 |
Гистопатологическое исследование. Гистопатологические срезы изучались на предмет присутствия апоптотических клеток у мышей с опухолью после проведения внутрибрюшного лечения препаратом BioBran. На рисунке 3А показано значительное повышение апоптотических опухолевых клеток у мышей, получавших лечение BioBran в сравнении с несколькими разбросанными индивидуальными апоптотическими клетками в у мышей с карциномой Эрлиха в группе PBS (Рисунок 3Б).
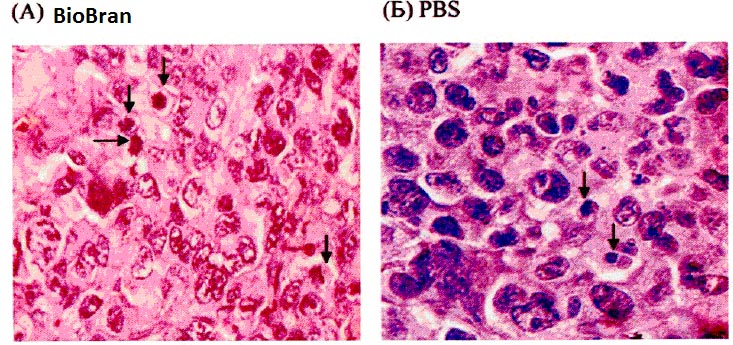
Рисунок 3. Срезы солидной карциномы Эрлиха у мышей. А: Срез опухоли при лечении BioBran демонстрирует обширный апоптоз. Б: Срез контрольной опухоли показывает, что большинство опухолевых клеток живы, за исключением нескольких областей апоптоза. (увеличение х400 с окраской гематоксилином и эозином, стрелки указывают на апоптотические клетки). PBS, буферный раствор фосфата.
Уровни цитокина
Эффект лечения при внутрибрюшном введении BioBran на плазменные уровни фактора некроза опухоли-альфа, интерферона–гамма и интерлейкина-10, измерявшийся на 35 день после трансплантации, показан в Таблице 4.
Таблица 4
Влияние внутрибрюшных инъекций BioBran на плазменные уровни цитокина у мышей с солидной карциномой Эрлиха на 35 день после введения опухолевых клетока
|
Группа
Параметры |
Контрольная группа (мыши без опухоли) |
Мыши с опухолью
PBS BioBran |
|
||
|
TNF-ɑ (пг\мл) Среднее ± ошибка среднего % измененийb № мыши IFN-γ (пг\мл) Среднее ± ошибка среднего % измененийb № мыши IL-10 (пг\мл) Среднее ± ошибка среднего % измененийb № мыши |
1.100 ± 10.4 - % 8
158.75 ± 19.8 - % 8
405.5 ± 25.0 - % 8 |
1.146 ± 16 (4.17%) 11
142.1 ± 10.6 -10.46% 11 858.5 ± 140.9с 111.71% 11 |
|
1,271.9 ± 13.5c,d (15.63%) 10
404.1 ± 58.3 c,d 154.54% 10
465.3 ± 30.0 c,d 14.75% 10 |
|
- Аббревиатуры означают следующее: PBS – буферный раствор фосфата, TNF-ɑ - фактор некроза опухоли-альфа, IFN-γ – интереферон-гамма, IL-10 – интерлейкин-10. Каждое значение представляет среднее ± ошибка среднего от указанного числа мышей.
- Процентное изменение в сравнении с контрольной группой.
- Статистически значимое отличие от контрольной группы при уровне 0.01.
- Статистически значимое отличие от группы мышей с лечением PBS при уровне 0.01.
Плазменные уровни фактора некроза опухоли-альфа. Данные в Таблице 4 показывают разницу в уровнях фактора некроза опухоли-альфа между мышами без опухоли в контрольной группе (1.100пг\мл ± 10.4) и мышами с опухолью в группе лечения PBS (1.46пг\мл ± 16). Однако лечение препаратом BioBran привело к значительно повышенному уровню производства фактора некроза опухоли-альфа (1.271пг\мл ± 13.5, Р<0.01) примерно на 11% выше, чем у мышей с солидной карциномой Эрлиха и на 15% выше, чем у мышей в контрольной группе.
Плазменные уровни интерферона-гамма. Мыши с опухолью в группе лечения PBS показали незначительные различия в плазменном уровне интерферона-гамма (142.1пг\мл ± 10.6) в сравнении с мышами без опухоли в контрольной группе (158.75±19.82). Лечение BioBran обнаружило повышенные плазменные уровни интерферона-гамма (404.1пг\мл ± 58.3, Р<0.01) по сравнению с 184.4% у мышей с опухолью в группе PBS и 154.54% у мышей в контрольной группе (Таблица 4).
Плазменные уровни интерлейкина-10. Данные, отображенные в таблице 4, иллюстрируют, что плазменные концентрации иммуносупрессивного цитокина интерлейкина-10 повышены более чем в 2 раза у мышей с опухолью в группе PBS (858.5пг\мл ± 140.9, Р<0.01) в сравнении с контрольной группой мышей без опухоли (405.5пг\мл ± 25.0, 111.71%). Введение BioBran привело к тому, что плазменные уровни интерлейкина-10 составили 465.3пг\мл ± 30.0, уровни аналогичные уровням у мышей без опухоли в контрольной группе.
Изучение NK-клеток
Активность NK-клеток. Активность NK-клеток изучалась 2 недели спустя после ежедневного внутримышечного введения BioBran. Используя клетки YAC-1, как мишени, мыши, получавшие лечение BioBran показали повышенную активность NK-клеток в сравнении с контрольной группой мышей, не получавших лечение при различных соотношениях Э:М (Рис. 4). Значительное повышение (в два раза) между контрольной группой и группой BioBran было обнаружено при каждом сравнительном коэффициенте: от 2,7% до 5.5% при 12.5:1; от 5.1% до 13.6% при 25:1; от 8.4% до 17.4% при 50:1 и от 10ю6% до 22.1% при 100:1. Если проводить вычисления в единицах лизиса, то статистический анализ выявил значительное повышение активности NK-клеток в группе BioBran (27.1 единиц лизиса) в сравнении с контрольной группой (8.3 единиц лизиса, Р<0.01).
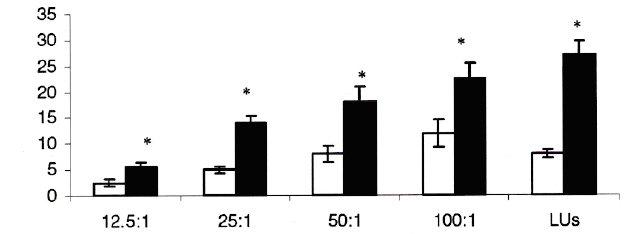
Соотношение Э:М
Рисунок 4. Влияние в естественных условиях BioBran на активность естественных леров (NK -клеток). Мыши без опухоли получали лечение BioBran в течение двух недель. Измерение активности селезеночных NK-клеток проводилось посредством микроцитотоксического теста с радиоактивным хромом и выражено в разных соотношениях Э:М (эффектор:мишень) и как единицы лизиса. Данные представляют среднее ± ошибка среднего от 3 мышей\групп. *Р <0.01 в сравнении с контрольной группой мышей, не получавших лечение.
Образование конъюгатов. Для определения, влияет ли лечение BioBran на способность NK-клеток привязываться к опухолевым клеткам-мишеням, мы сравнили процент образования конъюгатов между NK-клетками, полученными либо у мышей из группы BioBran, либо у мышей из контрольной группы, где изучались опухолевые клетки YAC-1. Как показано на Рисунке 5, пропорции клеток, образующих конъюгаты у мышей в группе BioBran были значительно выше (27.5%), чем у мышей в контрольной группе (14%, Р<0.01). Таким образом, пропорции оказались выше в два раза.
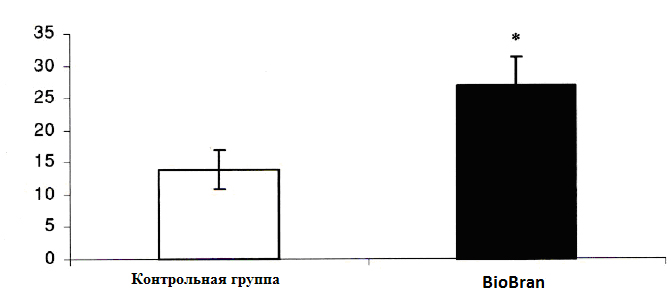
Рисунок 5. Распространение конъюгатов клеток-мишеней YAC-1 NK-клетками у мышей без опухоли, получавших лечение BIOBRAN. Клетки-эффекторы были взяты у контрольной группы и группы мышей, которых лечили BIOBRAN. *Р < 0.01 в сравнении с контрольной группой мышей, не получавших лечение.
Обсуждение
В данном исследовании мы изучали эффект BioBran на рост опухоли у швейцарских мышей-альбиносов с солидной карциномой Эрлиха в качестве подопытных особей. BioBran обнаружил потенциальное противоопухолевое действие в естественных условиях, что доказано значительной регрессией опухоли после внутрибрюшных и внутриопухолевых инъекций BioBran. Механизмы, благодаря которым BioBran проявляет свое противоопухолевое действие, связаны и с иммуномодулирующими, и с апоптотическими эффектами. Относительно иммунологии опухолей, опухоли характеризуются своей способностью избегать иммунную систему организма-хозяина. Опухоль Эрлиха – это быстро растущая карцинома с крайне агрессивным поведением. Она может избегать воздействия иммунного ответа хозяина, выделяя разные иммуносупрессивные цитокины, что приводит к дисфункции цитотоксичных клеток иммунологического надзора. Действительно, наблюдения, демонстрирующие, что дисбаланс в сети цитокинов связан с эволюцией опухоли, позволили создать базу для терапевтических подходов модификации производства цитокинов, обеспечивающих отторжение опухоли.
Результаты, представленные здесь, показывают, что BioBran является сильным стимулятором в естественных условиях и для фактора некроза опухолей-альфа и интерферона–гамма. Об этом уже сообщалось ранее после проведения лабораторных исследований на основе лимфоцитов периферийной крови человека, макрофагов и клеточных линий макрофага. Известно, что и фактор некроза опухолей-альфа и интерферон–гамма обладают сильной противоопухолевой активностью. Интерфероны типа I (фактор некроза опухолей-альфа и фактор некроза опухолей-бета) применяются для лечения гепатоклеточной карциномы. Интерфероны типа I активируют NK-клетки и цитолитические Т-лимфоциты посредством повышенного производства интерлейкина-1, интерлейкина-6 и фактора некроза опухолей-альфа. Кроме того, BioBran упорядочивает повышение плазменных уровней иммуноподавляющего цитокина интерлейкина-10, вызванное развитием опухоли, что замедляет синтез нескольких цитокинов, включая интерлейкин-2 и интерлейкин-3 в Th1 клетках (43,44) и интерлейкин-4 и интерлейкин-5 в Th 2 клетках (30), а также фактор некроза опухолей-альфа и интерферон–гамма в NK-клетках (45,46).
Другой механизм, благодаря которому BioBran способен вызывать регрессию опухоли – индукция апоптоза в раковых клетках посредством иммуномодулирующего влияния на NK-клетки и производство цитокина. NK-клетки играют очень важную роль в иммунологическом надзоре против вирусов и рака, как было показано, убивают клетки-мишени, в том числе и опухолевые клетки различными путями, как, например, путем индукции апоптоза в клетке после взаимодействия с Fas-лигандом (FasL) или Fas-рецептором. Предыдущие исследования показали, что пероральное введение BioBran у здоровых людей, а также лиц больных злокачественными новообразованиями и внутрибрюшное введение BioBran взрослым мышам, привело к активации деятельности NK-клеток. Результаты данного исследования подтверждают результаты предыдущих исследований и показывают активацию NK-клеток у мышей после внутримышечного введения BioBran швейцарским мышам-альбиносам. Интересно отметить, что исследователи Такахара и Сано (Tahara и Sano) показали, что пероральное введение BioBran раковым пациентам, которые получали химиотерапию, привело к усилению активности NK-клеток, что связано с большей продолжительностью жизни этих пациентов, по сравнению с теми, кто лечились только химиотерапией.
Аналогично, BioBran может вызвать апоптотический эффект посредством повышенного производства фактора некроза опухолей-альфа и интерферона–гамма. Интерферон-гамма типа I выступают для того, чтобы вызвать задержку клеточного цикла и апоптоз, а интерферон-гамма и фактора некроза опухоли-альфа действуют совместно для способствования смерти клеток рака посредством своего апоптотического и некротического влияния. Кроме того, BioBran сенсибилизирует CD95 рецепторы клеточной поверхности лейкемических клеток, которые участвуют в запуске апоптоза. Это предполагает, что данный натуральный продукт может принимать непосредственное участие в апоптозе солидных опухолей.
Противораковые терапевтические агенты индуцируют апоптоз в раковых клетках, но они остаются крайне токсичными. Модификаторы биологического ответа с иммуномодулирующими свойствами, в том числе интерлейкин-2, интерлейкин-12, интерлейкин-15 были ограничены в виду своей токсичности. Следовательно, остается необходимость в натуральном продукте, который не вызывает побочных эффектов.
Результаты данного исследования предоставляют важную информацию о возможностях BioBran вызывать быструю и значительную регрессию опухоли у мышей. Эта способность связана с иммуномодулирующими и апоптотическими возможностями BioBran. Данные исследования могут стать основной для проведения экспериментов в естественных условиях.
06 Март 2015
06 Март 2015


