Может ли стандартизированный растительный иммуномодулятор (концентрат арабиноксилана из рисовых отрубей/ MGN-3) увеличить эффекты ингибиторов MEK и BRAF с клинической пользой? Клинический случай пациентки с карциномой в желчном канале
Research and Review Insights, 2017 doi: 10.15761 / RRI.1000115 Том 1 (3): 1-4
Научная статья ISSN: 2515-2637
Абстракт
Коротко о сути проблемы: Таргетная гипер-активация сигнального пути (каскада) митоген-активированной протеинкиназой (MAPK) доказала свою эффективность в лечении различных видов рака. При использовании важного звена этого каскада, а именно ингибиторов MEK (митоген-активированных внеклеточных сигнальных регуляторов киназы), клинические ответы часто являются кратковременными, и полная ремиссия наблюдается редко. Образование устойчивых клонов в прогрессирующих опухолях представляется неизбежным. Недавние иммунологические и клинические наблюдения указывают на то, что в образовании этой резистентности может играть роль опухоль-индуцированное нарушение иммунорегуляции, по крайней мере, частично. А именно, было показано, что ингибиторы сигнального пути рецептора фактора роста могут увеличивать иммунную чувствительность опухолевых клеток, но они не способны активировать одавленную регуляторную функцию иммунных эффекторов. Следовательно, комбинация ингибиторов MAPK-каскадных сигнальных путей и иммуномодуляторов, активирующих иммунные эффекторы, может быть многообещающей новой стратегией.
Материал и методы: У 59-летней пациентки с неоперабельной (BRAF-мутация) низкодифференцированной аденокарциномой желчных протоков после 30GY лучевой терапии и двух циклов химиотерапии (Gemcitabin + Cisplatin) по результатам КТ и МРТ было установлено быстрое прогрессирование метастазов в легких, печени и головном мозге. После этого было начато лечение ингибиторами BRAF + MEK (2x150 мг дабрафениба и 1 x 2 мг траметиниба). Эти ингибиторы объединяли с ежедневным приемом концентрата арабиноксилана из рисовых отрубей 45 мг / кг (используя Biobran / MGN-3), который, как было показано, является подобием патоген-ассоциированных молекулярных паттернов (PAMP-молекул) и может стимулировать врожденные иммунные клетки 1-го типа против клеток опухоли. Результаты: после химиотерапии и до начала второй линии лечения у пациентки была почти терминальная фаза ее быстро прогрессирующего заболевания. Через восемь месяцев после комбинации ингибитора MEK / BRAF и иммуномодулятора по результатам КТ и МРТ была установлена почти полная ремиссия всех метастазов.
Заключение. Этот клинический случай может поддержать гипотезу о том, что ингибиторы MEK / BRAF и иммунные клетки 1 типа, активированные иммуномодулятором, способны синергически ингибировать рост опухоли. Для уточнения этого вопроса необходимы дальнейшие клинические исследования.
Соответствие: Тибор Хайто, профессор Медицинского университета Печ, Венгрия, тел. + 36-309-735-337; E-mail: drhajtot@t-online.hu Ключевые слова: ингибитор МЕК, траметиниб, ингибитор BRAF, дабрафениб, иммуномодулирующее лечение, опухолевое заболевание, рисовые отруби арабиноксилан, MGN-3. Поступило в редакцию: 23 августа 2017 г.; Принято: 25 сентября 2017 года; Опубликовано: 27 сентября 2017 г.
Введение
Ингибиторы MEK (митоген-активированных внеклеточных сигнальных регуляторов киназы) могут подавлять рецепторы тирозин-киназ, опосредующие передачу сигнала по сигнальному пути, посредством ингибирования митоген-активированной протеинкиназы / MAPK / каскада (RAS / RAF / MEK / ERK), который регулирует процессы пролиферации клеток, прогрессирования клеточного цикла и миграции клеток. Дисрегуляция каскада MAPK встречается более чем в одной трети всех злокачественных новообразований, что способствовало созданию таргетных ингибиторов пути MAPK [1]. Из-за широко распространенной активации этого пути во многих новообразованиях, ингибиторы МЕК изучаются в сочетании с другими таргетными и цитотоксическими препаратами в различных клинических ситуациях [2-4]. Ингибирующие соединения MEK продемонстрировали заметно усиленную активность против раковых клеток BRAF (V600E) по сравнению с клеточными линиями, лишенными этой канцерогенной мутации. Кроме того, между ингибиторами MEK и BRAF проявляется синергетический эффект [5].
Несмотря на улучшенные результаты лечения моноклональными антителами, нацеленными на различные звенья каскада MAPK, долговременные клинические ответы являются редкостью. Появление устойчивых клонов в прогрессирующих опухолях представляется неизбежным [6]. Недавние иммунологические и клинические наблюдения свидетельствуют о том, что в развитии этой резистентности также может играть роль опухоль-опосредованное нарушение иммунорегуляции, по крайней мере, частично. Несмотря на повышение чувствительности опухолевых клеток к иммунному разрушению под действием таргетных ингибиторов пути MAPK [7-8], наиболее важные иммунные эффекторные противоопухолевые клетки параллельно не активируются.
Известно, что опухолевые клетки способны полностью скрыться от лиганда Т-клеток, поскольку они проявляют генетическую дисрегуляцию, связанную с необратимыми количественными и качественными изменениями их антигенов MHC-I [9]. Следовательно, растущее внимание сосредоточено на механизмах врожденной иммунной системы, которые способны убивать опухолевые клетки не-МНС-ограниченным образом и, по-видимому, обладают более обратимыми механизмами ускользания, если сравнивать их с адоптивной системой. Как известно, эффекторные клетки врожденной иммунной системы получаются двумя путями. Макрофаги 1-го типа (M1) и дендритные клетки-моноциты типа 1 (DC1) генерируют (в строго регламентированной каскадной системе только на короткое время) провоспалительные цитокины, IL-12 и активируют цитотоксические эффекторные клетки (такие как NK и NKT), которые являются мощными ингибиторами роста опухоли. Однако эти клетки типа 1 являются дефектными у пациентов с опухолью. Имеющаяся информация свидетельствует о том, что связанные с опухолью макрофаги принадлежат к прототипической популяции M2 [10,11]. M2 –макрофаги и происходящие из предшественников плазмоцитоидов DC2-дендритные клетки продуцируют IL-4 и IL-10, которые облегчают образование Th2-клеток и ингибируют клетки Th1 и естественную систему типа 1 [10]. M2-макрофаги и CD2-дендритные клетки влияют на хроническое воспаление, способствуют пролиферации клеток путем продуцирования факторов роста и стимуляции ангиогенеза. У пациентов с опухолями может быть до 40% и более периферических моноцитов M2, тогда как у здоровых людей только 10% моноцитов M2 [10,11].
Как уже упоминалось, доминирование клеток M2 и CD2 у пациентов с опухолями может привести к усиленному образованию факторов роста, которые также способствуют снижению регуляции естественных иммунных клеток типа 1. Было показано, что факторы роста могут ингибировать цитотоксичность NK против раковых клеток путем снижения регуляции экспрессии так называемых стресс-зависимых рецепторов на мембране опухолевых клеток, а именно, связывающих NKG2D-лигандов Killing Activator Receptor (KAR): UL-16 связывающих белков (ULBP1 и ULBP2) или MICA и MICB [7,8]. Сопоставив эти наблюдения, мы можем заключить, что таргетные ингибиторы пути MAPK способны повысить чувствительность опухолевых клеток к иммунным эффекторам, но они не могут их активировать. Поэтому возникает гипотеза о том, могут ли иммуномодуляторы, которые способны активировать иммунные эффекторы (тип-1) против опухолевых клеток, улучшить действие таргетных ингибиторов пути MAPK. В этой статье представлен отчет о случае, который может поддержать эту гипотезу. Пациентку с неоперабельной (BRAF-мутантной) низкодифференцированной аденокарциномой билиарных протоков с метастазами в легких, печени и головном мозге лечили комбинацией ингибиторов MEK и BRAF и стандартизованного растительного иммуномодулятора (BioBran / MGN-3) с научно подтвержденным стимулирующим действием на клетки естественного иммунитета типа 1. Через четыре месяца лечения все метастазы показали почти полную ремиссию, которая была установлена через 8 месяцев.
Материалы и методы
Ингибиторы MEK и BRAF
В качестве ингибитора MEK 1 x 2 мг траметиниб и в качестве ингибитора BRAF 2x150 мг дабрафениба назначали с 4 июля 2016 года регулярно до марта 2017 года (период наблюдения). Пациентка постоянно проходила контрольные КТ и МРТ-исследования в онкологическом отделении Медицинского университета Дебрецен (Венгрия).
Стандартизованный экстракт рисовых отрубей (BioBran / MGN-3)
Иммуномодулирующее средство, используемое при комбинированном лечении представленной пациентки – BioBran / MGN-3, который производится и поставляется компанией Daiwa Pharmaceutical Co, Ltd, Токио, Япония. BioBran / MGN-3 состоит из денатурированной гемицеллюлозы, которая получена из гемицеллюлозы рисовых отрубей, взаимодействующей с несколькими гидролизующими углеводы ферментами грибов шиитаке. BioBran / MGN-3 стандартизирован по основному химическому компоненту: арабиноксилану с ксилозой (в основной цепи) и арабинозным полимером (в боковой цепи). Представленной пациентке BioBran / MGN-3 назначали перорально в дозах 45 мг / кг в первый день и на протяжении четырех месяцев три раза в неделю.
Комитет по этике
Комитет по этике предложил наблюдать и публиковать отчеты о конкретных клинических случаях пациентов, получающих стандартизированные растительные иммуномодуляторы. Пациентка дал информированное согласие на обработку и публикацию своих данных. Этот отчет о клиническом случае может стимулировать интерес других исследовательских групп в соответствии с мнением комитета по этике.
Результаты
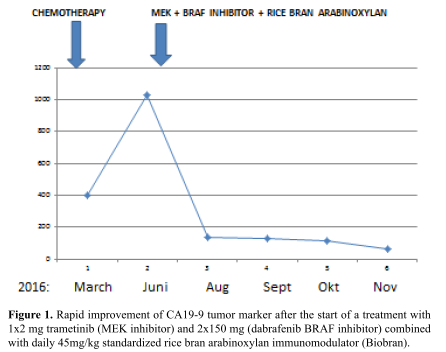
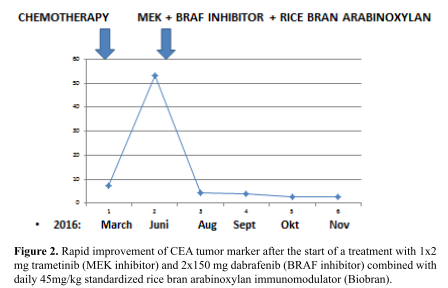
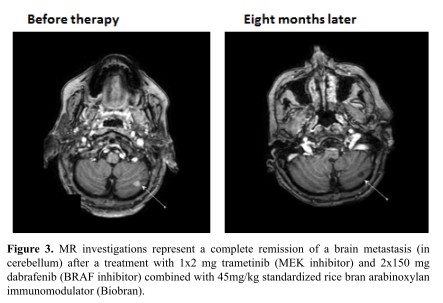
У 59-летней пациентки с неоперабельной низкодифференцированной аденокарциномой желчных протоков в апреле 2016 года болезнь перешла в терминальную стадию. По исследованиям ПЭТ / КТ мультиплексированные метастазы были обнаружены в следующих органах: легкие (S3); билатеральные медистинальные, парааортальные, паратрахеальные, трахеобронхиальные, подключичные лимфатические узлы; поджелудочная железа, ворота печени и брыжейка. Кроме того, при МРТ-исследовании были выявлены четыре метастаза в мозге (три в мозжечке и один в височной области). После облучения (30 GY WBRT) в мае / июне 2016 года пациентке были даны два цикла Цисплатина и Гемцитабина. В конце июня 2016 года установлено прогрессирование всех метастазов, и поэтому химиотерапия была прекращена. Поскольку в результате генетического исследования в начале июля 2016 года была обнаружена клинически значимая мутация водителя BRAF (V600E) и 22% TP53 (Q16fs * 28), в начале июля 2016 года больной назначили ингибитор MEK с ингибитором MEK 1 x 2 мг и ингибитор BRAF 2x150 мг (дабрафениб). В то же время, было начато иммуномодулирующее лечение стандартизованным концентратом арабиноксилана из рисовых отрубей (BioBran / MGN-3) в дозах 3 г в день в течение четырех месяцев, а затем три раза в неделю по 3 г. Во время этой комбинированной терапии наблюдалась очень быстрая ремиссия всех метастазов. На рисунках 1 и 2 показано быстрое снижение маркеров опухоли (СЕА и СА19-9) в периферической крови. Через четыре и восемь месяцев была установлена почти полная ремиссия (complete remissions, CR) всех метастазов с помощью КТ и МРТ. Рисунок 3 представляет CR метастазов головного мозга, сравниваются изображения перед лечением и восемь месяцев спустя.
Обсуждение
Влияние иммунной системы на ингибирующую терапию опосредованного тирозинкиназой сигнального пути плохо изучено, так как сейчас доступно очень мало результатов исследований. Хотя сигнальный путь обычно изображается как линейный каскад, почти весь канал сигнализации сильно взаимосвязан и образуют сети, которые обеспечивают динамическое регулирование его времени, силы и продолжительности. Кроме того, как действующие в прямом, так и в противоположном направлении, петли обратной связи обеспечивают средства для сигналов саморегулирования. Как следствие, один и тот же сигнал может вызывать разные исходы в зависимости от конкретного состояния клетки. Следовательно, они могут ингибировать или стимулировать в разных клетках [6]. Интересно, что это похоже на сходство между регулированием каскада MAPK и регулированием естественного иммунитета. Как уже упоминалось выше, эффекторные клетки врожденной иммунной системы также получаются двумя путями [10,11] и также могут играть важную роль в каскадной системе активации и ингибирования клеточной пролиферации. Как сигнальный путь протеинкиназы, так и врожденный иммунитет существуют в базальном состоянии, и они активируются только по мере необходимости с помощью расходящихся стимулов регуляции [12,13]. Механизмы переключения между бездействующим и активированным состояниями в обеих системах могут быть сложными, но, вполне вероятно, что оба сигнальных пути сильно взаимосвязаны и образуют сети. Поэтому неудивительно, что факторы роста стимулируют клеточную пролиферацию, с одной стороны, и защищают клетки (вплоть до регуляции их лигандов) от иммунных эффекторов, с другой стороны, вызывая уменьшение степени иммунной защиты от опухоли. Следовательно, комбинация действия ингибиторов сигнальных путей протеинкиназы и активированных иммуномодуляторами эффекторных клеток естественного иммунитета может открывать новые перспективы в терапии опухолей. Этот клинический случай может подтвердить данную гипотезу. Однако в будущем мы должны лучше научиться манипулировать регуляторными сетями, а время, сила и продолжительность ответов должны больше приниматься во внимание. Например, чем сильнее ответ, тем меньше можно давать препарат ежедневно, так как могут потребоваться свободные от лечения интервалы [13,14].
Патоген-ассоциированные молекулярные паттерны (PAMP-молекулы) являются лучшими кандидатами на комбинацию таргетной терапии с иммуномодуляцией. Однако молекулы PAMP существуют только в природе (бактерии или растения). Химический синтез не в состоянии воспроизвести эти конфигурации. Бактерии имеют токсические побочные эффекты, но растения их не имеют. К сожалению, лучшие стандартизированные иммуномодуляторы с клинически подтвержденным действием без каких-либо побочных эффектов являются растительными экстрактами, и они во всем мире зарегистрированы только в качестве пищевых добавок. Имеются растущие свидетельства того, что PAMP-подобные молекулы растений (такие как стандартизованный концентрат арабиноксилана из рисовых отрубей), демонстрируют много иммунологических [15-26] и клинических преимуществ [27-29]. Поэтому для исследования этого полезного взаимодействия необходимы дальнейшие клинические испытания.
Заявление о раскрытии информации
Авторы заявляют, что не существует конкурирующих или других противоречащих друг другу интересов в отношении этой статьи.
Рисунок 1. Быстрое улучшение опухолевого маркера CA19-9 после начала лечения с помощью 1 мг 2 мг траметиниба (ингибитор MEK) и 2x150 мг дабрафениба (ингибитор BRAF) в сочетании с ежедневным приемом стандартизованного иммуномодулятора арабиноксилана из рисовых отрубей 45 мг / кг (Biobran).
Рисунок 2. Быстрое улучшение маркера опухоли CEA после начала лечения 1x2 мг траметиниба (ингибитор MEK) и 2x150 мг дабрафениба (ингибитор BRAF) в сочетании с ежедневным приемом стандартизованного иммуномодулятора арабиноксилана из рисовых отрубей 45 мг / кг (Biobran).
Рисунок 3. МРТ-исследования представляют собой полную ремиссию метастазирования в головной мозг (в мозжечок) после лечения 1х2 мг траметиниба (ингибитор МЕК) и 2x150 мг дабрафениба (ингибитор BRAF) в сочетании со стандартизованным иммуномодулятором из рисовых отрубей в дозе 45 мг / кг (Biobran).
06 Март 2015
06 Март 2015


