MGN-3/BIOBRAN усиливает выработку цитотоксических cd8+ Т-клеток за счет активации DEC-205 экспрессии на дендритных клетках
Arabinoxylan из рисовых отрубей (MGN-3/Biobran), как было доказано, является мощным модификатором биологического отклика (МБО), который активирует различные звенья иммунной системы, в том числе дендритные клетки (ДК, дендроциты), инициирующие СD4+ хелперы Т-клеточной иммунной реакции. В настоящем исследовании изучалась способность MGN-3-активированных ДК инициировать CD8+ Т- клетки и рассматривались механизмы, лежащие в основе этого эффекта. Моноцитарные дендритные клетки человека обрабатывались MGN-3 (в концентрации 20 и 40 мкг/мл). Результаты показали, что обработка MGN-3 приводит к интенсивной инициации гранзим B-экспрессирующих CD8+ Т-клеток. У сенсибилизированных опухолевым лизатом и MGN-3 ДК также увеличивалась способность убивать раковые клетки по сравнению с ДК-стимулированными CD8+ Т-клетками. Это было связано с: I) повышенной экспрессией DEC-205 в MGN-3-активированных ДК дозозависимым образом; и II) MGN-3 привела к значительному усилению выработки интерферона III типа, IL29, но не ИФН I типа или типа Б. Эти результаты позволяют предположить, что MGN-3 – мощный натуральный адъювант, который эффективно активизирует дендроциты, и поэтому может быть полезен для повышения эффективности иммунного ответа против инфекций и рака.
Противораковое действие пищевых рисовых отрубей было протестировано в нашей и других лабораториях. Арабиноксилан из рисовых отрубей (MGN3/BioBran) показал выраженный опухоль-ингибирующий эффект в исследованиях на животных и клинических испытаниях пациентов с гепатоцеллюлярной карциномой. Другие дериваты рисовых отрубей также подавляли рост опухоли в опытах на животных. Механизмы, благодаря которым биоактивные компоненты рисовых отрубей проявляют противоопухолевый эффект, включают индуцирование апоптоза, антиоксидантное действие и захват свободных радикалов, ингибирование клеточной пролиферации и альтерации в клеточном цикле. К тому же, иммуномодулирующий эффект дериватов рисовых отрубей усиливает действие различных клеток иммунной системы, таких как T и B клетки, NK-клетки и дендритные клетки (дендроциты, ДК).
Дендроциты – одни из главных клеток, участвующих в формировании противоопухолевого иммунного ответа. Зрелые дендроциты мигрируют к лимфоидным органам, презентуют антигены Т-лимфоцитам и быстро повышают иммунный ответ. В настоящее время проводятся многочисленные опыты на животных и разнообразные клинические испытания методов иммунотерапии, основанных на действии дендроцитов. Некоторые связывающиеся с дендроцитами рецепторы, так называемые образ-распознающие рецепторы PRRs, выступают в качестве главных распознавателей патогенов.
Связывание дендроцитов с лигандами или агонистами посредством этих образ-распознающих рецепторов приводит к их активации и выработке цитокинов, которые вызывают активацию Т-клеток. Распознавая специфические патогены, дендроциты обучают CD4+ Т-клетки дифференцировать один или несколько типов эффекторов и регуляторных клеток. Благодаря запоминанию этих признаков, PRRs могут быть использованы как иммуноактивирующие агенты. Ученые пытаются найти лучшие иммуноактивирующие агенты, такие как модификаторы биологического отклика (МБО, биомодуляторы, BRM), для борьбы с инфекциями и раком. Как оказалось, обработка МБО MGN-3 может приводить к активации и созреванию дендроцитов, продуцированию нескольких видов цитокинов и активированию дендроцитов для подготовки CD4+ Т-клеток к пролиферации и выработке цитокинов. С другой стороны, целью настоящего исследования было изучение роли MGN-3–стимуляции дендроцитов в производстве CD8+ цитотоксичных Т-лимфоцитов (CTL) и механизмов, лежащих в основе этого эффекта. Мы обнаружили, что MGN-3 активирует дендроциты первой ступени, интенсивно инструктируя гранзим-B-экспрессирующие CD8+ клетки. Кроме того, MGN-3-активация дендроцитов стимулирует опухольлизирующую активность CD8+ клеток, что демонстрируется увеличением гибели клеток опухоли. Эти результаты могут быть ассоциированы с увеличением экспрессии DEC-205 и продуцированием ИФН III типа. Это означает, что MGN-3 функционирует как природный стимулятор активации дендроцитов и, в связи с этим, может быть использован для создания вакцин против инфекций и рака на ДК-основе.
Материалы и методы
Антитела и реагенты
Использовались следующие античеловеческие антитела: DEC-205, Alexa647, 7-AAD, гранзим B, CD8+ PerCP вместе с соответствующими изотипическими антителами в качестве негативного контроля, все –производства BD Biosciences (Сан-Луис, штат Калифорния, США). FACS проточный цитометрический анализ выполнялся с помощью проточного цитофлюориметра FACS Calibur (Becton Dickinson, Сан-Луис, штат Калифорния, США) с использованием программного обеспечения Flowjo (Tree Star, Inc., Эшленд, Орегон, США). Человеческий гранулоцит-макрофаг/рекомбинантный человеческий IL-4 был закуплен в компании PeproTech (Роки Хилл, Нью-Джерси, США). Набор для негативной селекции был закуплен в STEMCELL Technologies Inc. (Ванкувер, Канада).
MGN-3/BioBran
Арабиноксилан из рисовых отрубей (MGN-3/BioBran) получается при реакции гемицеллюлозы из рисовых отрубей с комплексом гидролизирующих углеводы ферментов из грибов шиитаке. Основа химической структуры MGN-3 – арабиноксилан, с ксилозой в главной цепочке и полимером арабинозы в боковой цепочке. MGN-3 был любезно предоставлен компанией Daiwa Pharmaceuticals Co.Ltd., Токио, Япония.
Выделение и культивирование дендроцитов моноцитарного происхождения
Дендроциты моноцитарного происхождения были приготовлены в целом так же, как это было описано ранее. Коротко говоря, мононуклеарные клетки периферической крови (МКПК) от здоровых доноров (одобренные участники исследования (IRB) в Университете Чарльза Дрю) были фракционированы в процессе Ficoll гипак градиентного центрифугирования. Клетки были выдержаны для осаждения в культуральных чашках в течение 2 часов. После этого неосажденные клетки были убраны. Осажденные моноциты были культивированы в течение 6 дней во влажной атмосфере с 5% содержанием CO при температуре 37°C в бессывороточной среде (AIM-V) с человеческим гранулоцит-макрофагом/рекомбинантным человеческим IL-4. Половина питательной среды каждые 2 дня пополнялась свежей средой, и через 6 дней дендроциты были отобраны. Степень гомогенности полученных ДК была • 95%. Дендроциты были впоследствии активированы либо 100 ng/ml LPS E.coli в качестве позитивного контроля либо MGN-3 (20 или 40 мкг/мл) в течение 24 часов.
ДК фенотипирование
Уровень экспрессии маркеров клеточных поверхностей было определен с помощью цитометрии. Коротко говоря, популяция клеток CD11c+HLA-DR+DCs была проанализирована по экспрессии DEC-205 с подходящими изотипическими антителами.
Выработка цитокинов дендроцитами
Незрелые ДК были инкубированы либо с LPS (100 ng/ml) либо с MGN-3 (20, 40 мг/мл) в течение 24 часов. Супернатант был отобран и хранился при -70°C до момента исследования. Интерфероны типа III (IL29) из PBL и типа I ИФН α и β из RnD-системы были определены с помощью набора ELISA согласно протоколам изготовителей.
Культивирование DC-CD8+ T-клеток для гранзим-B индуцирования
Незрелые дендроциты были стимулированы с помощью LPS и MGN-3 (в концентрации 20 мкг/мл) как указано выше. Через 24 часа клетки были выделены и промыты. После промывки дендроциты в концентрации 2х104 были культивированы с очищенными аллогенетическими CD8+ Т-клетками в концентрации 1х105. Через семь дней клетки были отобраны и поверхностно окрашены с CD8 PerCP. После фиксации с 4% параформальдегидом в течении 15 минут при 37°C клетки были промыты и пермеабилизированы (BD Perm Buffer). Затем клетки были окрашены с антителами к гранзимам B и выделены для изотипического контроля (BD Biosciences, Сан-Луис, Калифорния). Селектированные CD8+ Т клетки были исследованы на наличие гранзимов B.
Культивирование DC-CD8+ T-клеток для лизиса опухолевых клеток
Дендроциты (в концентрации 1х106 ) были стимулированы MGN-3 и опухолевым лизатом PC3 (клетки рака простаты, Американская коллекция типов культур, Манассас, Вирджиния). Через 24 часа клетки были отобраны и промыты. 2х104 ДК были культивированы с очищенными аллогенетическими CD8+ Т-клетками в концентрации 1х105 вместе с лизатом опухоли в течении 7 дней. PC3 специфические аллогенетические CD8+ Т-клетки были получены с помощью импульсированных МКПК с лизатом опухоли PC3 в течении 10 дней. Впоследствии CD8+ Т-клеток были очищены от культуры с помощью негативного отбора с использованием магнитных микроносителей. Очищенные CD8+ Т-клетки (эффекторы) инкубировались с помощью CFSE-маркированных PC3-клеток (мишеней) при коэффициенте соотношения мишени и эффектора 1:50 в объеме 200 мл. Нанесение клеточного маркировочного красителя CFSE отделяет мишени от эффекторов. Через 4 часа после этого 5 мл 7AAD было добавлено к клеткам для окрашивания мертвых клеток. 7AAD входил только в мембрану дефектных (аномальных) клеток и связывался с ДНК. Клетки были получены на FACS Calibur через 10 минут после добавления 7AAD. 10 000 CFSE-позитивных клеток были отобраны на основании их характеристик. Контроли включали CFSE-окрашенные PC3-клетки без эффекторов и 7AAD+CFSE-окрашенные PC3-клетки. Анализ осуществлялся с помощью синхронизации на клетках-мишенях и измерении соотношения 7AAD-негативных и 7AAD-позитивных клеток. Позитивные клетки как для 7AAD так и для CFSE считались лизированными. Процент цитотоксичности подсчитывали с помощью следующего уравнения: (7AAD-позитивные + CFSE-позитивные клетки / на общее число CFSE-позитивных клеток) х 100.
Статистика
Все эксперименты повторялись с использованием образцов – от 4 до 6 отдельно исследуемых объектов. Вероятность средних величин в двух экспериментальных группах была проанализирована с помощью двустороннего Т-теста для парных образцов. Уровень значимости был установлен на p ˂0,05. Статистический анализ гистограмм осуществлялся с использованием программного обеспечения Graf Pad Prism.
Результаты
DEC-205 экспрессия
Дендроциты были либо обработаны с помощью MGN-3 (20 и 40 мкг/л), или с помощью LPS (100 нг/л), либо оставлены нетронутыми. Уровень ДК-активации был исследован при всех трех состояниях. Данные, отображенные на рисунке 1, показывают экспрессию DEC-205. Проточный цитометрический анализ выявил повышенную экспрессию DEC-205 в MGN-3 -активированных ДК в дозозависимой степени.
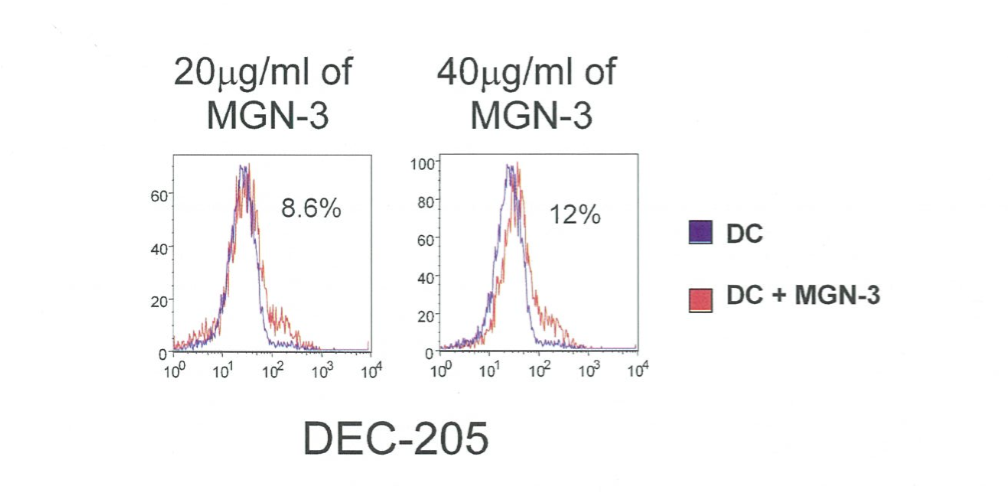
Биобран активирует ДК для индуцирования DEC-205. Гистограмма отображает процент позитивной экспрессии DEC-205 дозозависимым образом под действием MGN-3 (20 и 40 мкг/л).
MGN-3-активированные ДК секретируют ИФН типа I и III
На рисунке 2 отображена секреция ИФН типа I и III после обработки ДК с использованием MGN-3 в концентрации 20 мг/л. Рисунок 2А показывает, что MGN-3 индуцирует ДК, вызывая значительное увеличение продуцирования ИФН типа III (ИЛ29). Эффект MGN-3 был значимым (p ˂0,05) по сравнению с изолированными ДК. Обработка MGN-3 повлекла за собой усиленную выработку ИФН I типа α (рисунок 2 B) и β (рисунок 2 С). Однако данное увеличение не было статистически значимым.
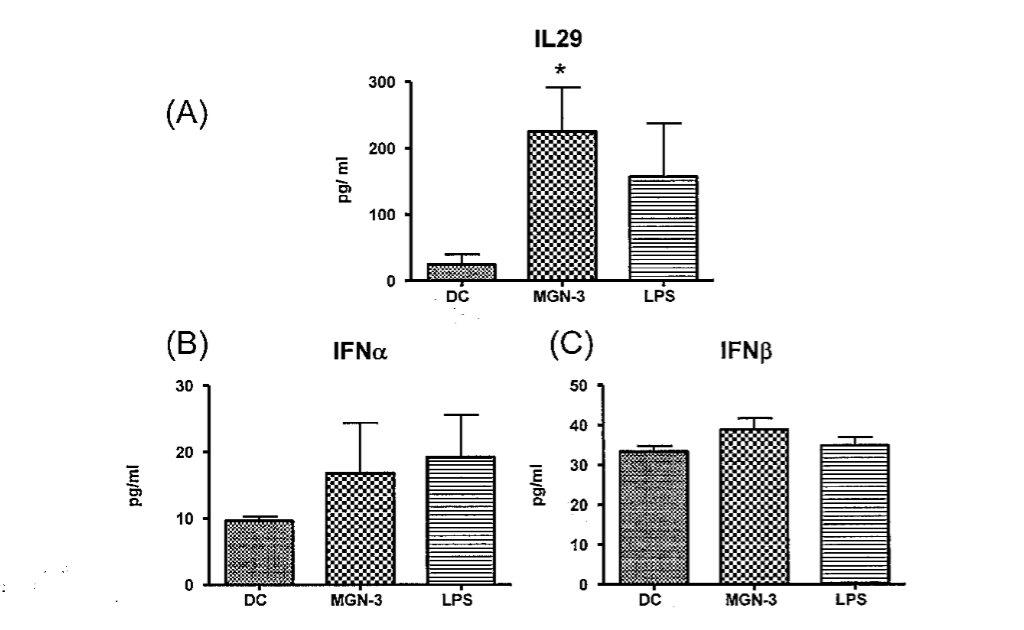
MGN-3 в концентрации 20 мкг/л активирует ДК для индуцирования секреции цитокинов ИФН I и III. ДК были активированы с помощью MGN-3 и LPS в течение 48 часов. Гистограммы отображают: А – уровень ИЛ 29 (тип III, ИФНs), B – ИФНα, и C – ИФНβ. Данные представлены в средних значениях ± S.E., полученных от 6 экспериментов (p ˂0,05), в сравнении с необработанными ДК.
MGN-3 индуцирует гранзим-экспрессивные цитотоксичные CD8+ T-клетки
ДК также вызывают возникновение цитотоксических CD8+ T-клеточных ответов. Чтобы это исследовать, мы установили действие MGN-3-стимулированных ДК на CD8+ T-клетки. ДК культивировали в течение 24 часов с MGN-3 в концентрации 20 мкг/л. Затем их промыли и культивировали с очищенными CD8+ T-клетками. Через 7 дней после этого клетки были собраны и окрашены внутриклеточно по гранзиму B. ДК, стимулированные с помощью MGN-3, индуцировали значительно более высокие уровни гранзимов В-позитивных CD8+ T-клеток (p ˂0,05) по сравнению с нестимулированными ДК CD8+ T-клетками (рисунок 3 А и B). Эти данные наводят на мысль о том, что стимулирование ДК посредством MGN-3 высокоэффективно в примировании цитотоксических Т-клеточных реакций.
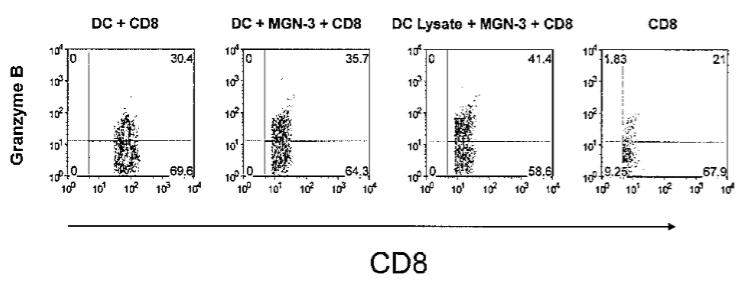
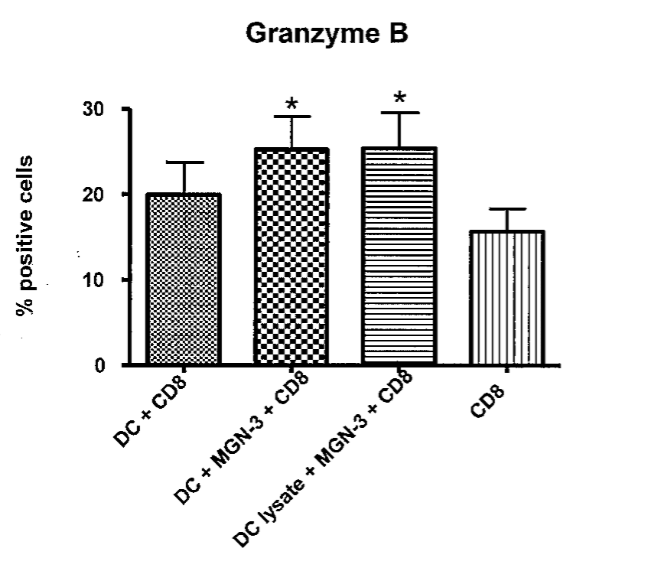
MGN-3 в концентрации 20 мкг/л индуцирует экспрессию гранзимов цитотоксическими ДК-активированными MGN-3 и лизатом раковой опухоли+ MGN-3 сокультивированными с CD8+ T-клетками в течении 7 дней. А) Индукция гранзима была определена с помощью проточной цитометрии B) Гисторгаммы отображают процент CD8+ T-клеток, экспрессирующих гранзим B. Средние значения данных ± S.E., полученные от 5 экспериментов (p ˂0,05), представлены в сравнении с нестимулированными ДК CD8+ T-клетками.
Примирование MGN-стимулированных ДК с высокой цитолитической активностью
Гранзим-экспрессирующие CD8+ T-клетки могут убивать раковые клетки. PC3-клетки были использованы в качестве раковых клеток-мишеней. PC3-специфические CD8+ T-клетки были получены как описано в «Методах». Чтобы определить гибель или лизис, очищенные CD8+ T-клетки (эффекторы) были со-культивированы с CFSE-маркированными PC3-клетками в качестве мишеней при соотношении мишеней и эффекторов (T:E) 1:25 и 1:50. Через 4 часа к клеткам был добавлен 7AAD для окрашивания погибших клеток.
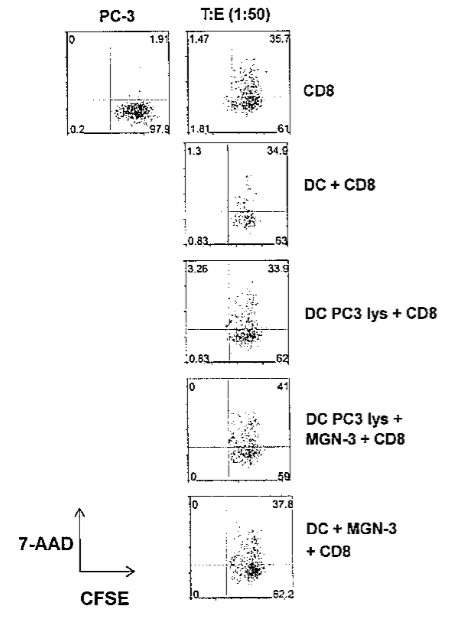
MGN-3 -стимуляция примирует более высокие цитолитические CD8+ T-клетки. ДК, активированные MGN-3 в концентрации 20 мкг/л и лизатом раковых клеток + MGN-3 были сокультивированы в течение 7 дней. Очищенные CD8+ T-клетки (эффекторы) были со-культивированы с CFSE-окрашенными PC3-клетками в отношении 1:50. Клетки, позитивные для обоих проб, считались лизированными. Исследование методом проточной цитометрии показывает процент специфического лизиса PC3. Данные от одного представительного эксперимента отображены в сравнении с нестимулированными CD8+ T-клетками.
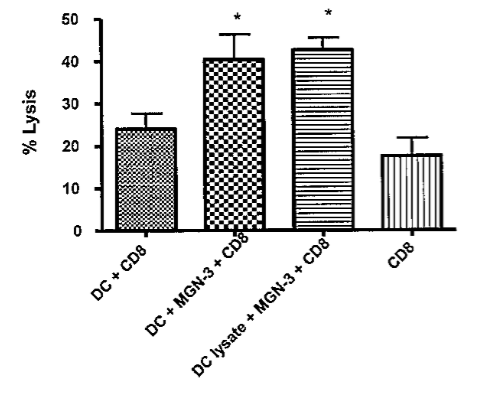
Контроли включали CFSE-окрашенные PC3-клетки без эффекторов и 7AAD и CFSE-окрашенные PC3-клетки. Анализ осуществлялся помощью гейтирования на клетках-мишенях и измерения 7AAD-негативных клеток в соотношении с 7AAD-позитивными. Клетки позитивные как для 7AAD, так и для CFSE считались лизированными. Рисунок 4 отображает проточно-цитометрические исследования, показывающие процент специфического лизиса PC3-клеток от одного репрезентативного эксперимента. MGN-3 в концентрации 20 мг/л, а также опухоль лизат-импульсные MGN-3- стимулированные ДК примировали CD8+ T-клетки с более высокой цитотоксической активностью (38% лизиса и 41% лизиса соответственно) по сравнению с нестимулированными ДК-примированными Т-клетками (35% лизис). Подобная тенденция также наблюдалась при более низком соотношении мишеней и эффекторов (1:25), но в меньшей степени (данные не отображены). Рисунок 4 B показывает результаты (средние величины с +- S.E.) от 5 экспериментов. Нестимулированные ДК- примированные CD8+ T-клетки, а также изолированные CD8+ T-клетки показали 24% и 18% лизиса, в то время как MGN-3-стмулированные ДК – 44% лизиса (p ˂0,05 по сравнению с ДК CD8+ T-клетками). Эти данные со всей очевидностью позволяют предположить, что стимулированные MGN-3 ДК индуцируют высокоцитотоксические CD8+ T-клетки. Опухоль лизат-импульсные MGN-3-активированные дендроциты стимулировали гибель CD8+ опухолевых клеток еще в более высокой степени.
Обсуждение
Предыдущие исследования, проведенные нашей и другими группами, показали возможность MGN3/BioBran индуцировать взросление и активацию ДК. Первичные исследования показали, что MGN3 индуцировал повышение экспрессии ДК-костимулирующих маркеров и производство провоспалительных и иммунорегулирующих цитокинов (15, 16). MGN-3-стмулированные ДК индуцируют пролиферацию CD4+ T-клеток и производство цитокинов ИФН-γ, IL-10 и IL17 (15). Однако есть ограниченный объем информации, касающейся паттерн-распознающих рецепторов, вызывающих распознавание MGN-3. Данное исследование было смоделировано для изучения роли MGN-3-стмулированных ДК в выработке CD8+ T-клеток и цитотоксических Т-лимфоцитов CTLs. Результаты данного исследования показали увеличение экспрессии DEC-205 в MGN-3-активированных ДК в дозозависмой степени.
DEC-205 принадлежит макрофаговым маннозным рецепторам из семейства C-типа лектин-эндоцентичных рецепторов. DEC-205 – это белок клеточной поверхности I типа, главным образом экспрессируемый при ДК-повышающей регуляции во время взросления дендроцитов. (22, 24, 25). Он имеет эндоцитирующую активность и способствует презентации антигенов с помощью ДК. В данном исследовании мы также показали повышенную секрецию ИФН III типа с помощью ДК. ИФН III типа или интерфероны λs, также известные как ИЛ 28/29 – важные регулятор системы защиты кожи. Они играют важную роль в очищении от вирусных и микробных инфекций и борьбе с опухолями. Главным образом, они представлены в эпителиеподобных тканях, тогда как рецепторы ИФН типа I представлены в большинстве типов клеток. Как ИФН I типа, так и ИФН III типа демонстрируют одинаковую экспрессию и биологическую активность. Но они могут играть различные роли в антивирусных и антираковых реакциях. Например, Agrawal показал, сигнальные клетки с ИФН III типа могут обладать более выраженным антивирусным эффектом вследствие повышенной выработки и продолжительного действия в мукозальных компартментах, расположенных снаружи (30). Интерферон III типа был определен как мощный эффектор иммунной системы в стимулировании цитотоксических эффектов CD8+ T-клеток, направленных на разрушение раковых клеток. Результаты данного исследования показывают, что MGN-3-активированные ДК примировали CD8+ T-клетки для более высокого уровня экспрессии гранзима В, а опухоль лизат-импульсные MGN-3-активированные ДК стимулировали CD8+ T-клетки, что вызывало их более высокую активность по уничтожению раковых клеток. Эти результаты ассоциируются с повышенным уровнем экспрессии DEC-205. Некоторые исследования указывают на решающую роль DEC-205 и CD8+ T-клеточных ответов в отношении рака и вирусов. DEC-205 важен для поглощения экстрацеллюлярных протеинов. После присоединения к DEC-205 протеины поглощаются, обрабатываются и презентуются в комплексе с MHC II. Когнитивные Т-клетки симулируются к пролиферации. Экспрессия DEC-205 положительно коррегирует с клеточными реакциями CD8+ T-клеток.
Заключение
Данные этого исследования позволяют предположить, что MGN-3 функционирует как натуральный активант для ДК-активации. Будущие исследования, возможно, будут направлены на изучение использования MGN-3 в качестве антивирусного агента, который повышает мукозальные ответы посредством секреции ИЛ 29, активации DEC-205 и генерации CTL. И, таким образом, может быть использован в базирующихся на ДК тактиках вакцинации против инфекций и рака.
Благодарности
Мы хотим поблагодарить доктора Gollapudi, UC Irvine, за его сопровождение данного исследования. Мы также хотим поблагодарить Джулию Колландер за тщательное редактирование данной статьи. Данная работа была поддержана грантом #C0030300 от Daiwa Pharmaceutical Co., Ltd., Япония.
06 Март 2015
06 Март 2015


