Доказательное исследование Биобрана/ Mgn-3, содержащего арабиноксилан, в качестве комплементарной терапии для традиционного лечения рака
СУ Лян Оои, MMath, К Bhsc (Comp Med)(1), Дебби Макмаллен, BHSc (Comp Med)(2), Терри Голомбик, доктор медицинских наук, Dipl Nut (3), и Сок Чхон Пак, доктор медицинских наук (2)
Абстракт
Введение: Традиционное лечение рака, включая хирургию, химиотерапию и лучевую терапию, может оказаться недостаточным для уничтожения всех злокачественных клеток и предотвращения рецидивов. Интенсивное лечение часто приводит к депрессии иммунной системы, лекарственной устойчивости и интоксикации, что затрудняет получение ожидаемых результатов. Биобран / MGN-3 представляет собой стандартизированный концентрат арабиноксилана, который был предложен в качестве иммуномодулятора на основе растительного сырья, способного восстановить вызванное опухолью нарушение естественной иммунной системы, включая активность клеток-натуральных киллеров (NK) для борьбы с раком, дополняющей обычные методы лечения.
Цели: Всесторонне проанализировать имеющиеся данные о влиянии и эффективности MGN-3 в качестве дополнительной терапии для традиционной терапии рака.
Методы: системный поиск протоколов баз данных и «серой» литературы с первичными исследованиями, сообщающих о действии MGN-3 на рак и на лечение рака.
Результаты. В этот обзор были включены тридцать полнотекстовых статей и тезисы 2 конференций. Установлено, что MGN-3 обладает иммуномодулирующими противораковыми эффектами и может работать синергически с химиотерапевтическими агентами in vitro. Показано, что в мышиных моделях MGN-3 действует против канцерогенных агентов и ингибирует рост опухоли либо сам по себе, либо в сочетании с другими противораковыми соединениями. Было найдено 14 успешных клинических случаев лечения MGN-3. Было обнаружено 11 клинических исследований, в том числе 5 пре/пост нерандомизированных исследований и 6 рандомизированных контролируемых исследований (РКИ). Описанные эффекты включают усиление иммунопрофиля, снижение побочных эффектов, улучшение результатов лечения; в одном из РКИ установлено значительное повышение выживаемости. Нет сообщений о неблагоприятных последствиях лечения MGN-3. Большинство клинических испытаний – небольшие исследования с небольшой продолжительностью.
Заключение. Имеется достаточное количество доказательств того, что MGN-3 является эффективным иммуномодулятором, который может дополнять традиционную онкотерапию. Однако для укрепления доказательной базы необходимы масштабные РКИ MGN-3.
Ключевые слова: MGN-3, Биобран, Арабиноксилан, Ribraxx, систематический обзор, рак, альтернативная медицина, химиотерапия, хемопротекция, иммуномодуляция, иммунотерапия, вспомогательная терапия, рисовые отруби, аденокарцинома, канцерогенез. Отправлено 11 июня 2017 года; отредактировано 6 августа 2017 года; принято 12 сентября, 2017.
Введение
Рак – основная причина смертности: по данным статистики 14,1 миллиона новых случаев и 8,2 миллиона смертей от рака произошло во всем мире в 2012 году 1. Традиционное лечение рака, включая хирургию, химиотерапию и лучевую терапию, которая направлена на устранение раковых клеток, может быть эффективным в краткосрочной перспективе 2. Однако такого подхода недостаточно для уничтожения всех злокачественных клеток, особенно при распространенном раке, что приводит к рецидиву. Повторные циклы интенсивного лечения могут подавлять иммунную систему, стимулировать химиотерапевтически и радиотерапевтически резистентные опухоли, а также приводить к местной и общей интоксикации.3 Иммунотерапия, в которой нехимические биологические вещества, называемые модификаторами биологического ответа (BRM) или иммуномодуляторами, используются для индуцирования или восстановления естественной защитной способности организма для борьбы с раком, 4 в настоящее время признается важной стратегией лечения, которая может работать в сочетании с традиционной терапией.5,6
Биобран/MGN-3 Арабиноксилан (MGN-3) представляет собой смесь натуральных гемицеллюлоз, полученных из рисовых отрубей, частично гидролизованных ферментами грибов шиитаке (экстракт мицелия Lentinus edodes). Он разработан и изготовлен в Японии компанией Daiwa Pharmaceutical Co, Ltd и продается во всем мире в качестве нетоксичной пищевой добавки под разными торговыми марками, такими как BioBran (Биобран) (во всем мире), Lentin Plus (Япония / Азия), Ribraxx (Австралия / Новая Зеландия), BRM4 (Соединенные Штаты) и др.7 Основной химической структурой MGN-3 является арабиноксилан с ксилозой в основной цепи и полимером арабинозы в боковой цепи. Результат анализа метилирования показывает, что сложная структура гетерополисахарида (арабиногалактан, арабиноксилан, арабинан, β-1,3: 1,4-глюкан) обеспечивает иммуномодулирующие механизмы и противоопухолевую активность MGN-3 8. Использование MGN-3 как BRM на растительной основе, способствующего улучшению работы истощенной иммунной системы во время и после традиционной терапии рака, требует подтверждения результатами научных исследований и положительными результатами применения в клинической практике.9
Цели исследования
Провести всесторонний обзор литературы по имеющимся данным о влиянии и эффективности MGN-3 в качестве дополнительной терапии для поддержки традиционной терапии рака.
Методы
Систематические поиски проводились с использованием исследовательских баз данных, включая PubMed, ProQuest, MEDLINE, EBSCOhost (All), Cochrane CENTRAL, Embase и EBM Review (All) без каких-либо ограничений по году публикации. Используемые ключевые слова включают «MGN-3», «BioBran», «arabinoxylan», «рисовые отруби» и «растительные иммуномодуляторы» в сочетании с «раком» или «химиотерапией». Кроме того, сборник статей об MGN-3, опубликованных на BioBran Research Foundation (10), официальном сайте MGN-3 (https://biobran.org), англоязычной версии сайта Daiwa Pharmaceutical (http: // www. Daiwa-pharm.com/english) и ссылки во включенных в них статьях были исследованы вручную. Критерии включения: (1) первичные исследовательские отчеты, опубликованные на английском языке, включающие in vitro, in vivo, клинические исследования и отчеты о случаях заболевания, и (2) исследования, посвященные воздействию MGN-3 на любую форму рака при изолированном лечении или в качестве комбинированной терапии/ комбинированным эффектам MGN-3 с одним или несколькими химиотерапевтическими агентами / действию MGN-3 на больных раком.
Результаты
Результаты поиска
Результаты систематического поиска были проведены 2 авторами (DM и SLO) независимо друг от друга в период с марта по май 2017 года. В результате изысканий было найдено 166 уникальных записей. После первоначального отбора 48 статей были оценены на предмет соответствия критериям отбора. Шестнадцать статей были исключены по следующим причинам: дублирование (5),11-15 не ориентированы на рак (7),16-22 не первичные исследования (3) 23-25 , также была исключена 1 статья, опубликованная на японском языке. В обзор включены 26 полнотекстовых статей, тезисы докладов 2 конференций, состоящий из 7 обзоров исследований in vitro;27-33 1 статья с отчетами о результатах как in vitro, так и in vivo исследований;34 7 in vivo исследований;35-41 6 отчетов о клинических случаях;42-47 и 11 клинических исследований,48-58 одно из них также включало отчеты наблюдений за отдельными пациентами впослествии.48 Последовательность поиска литературы представлена на рисунке 1.
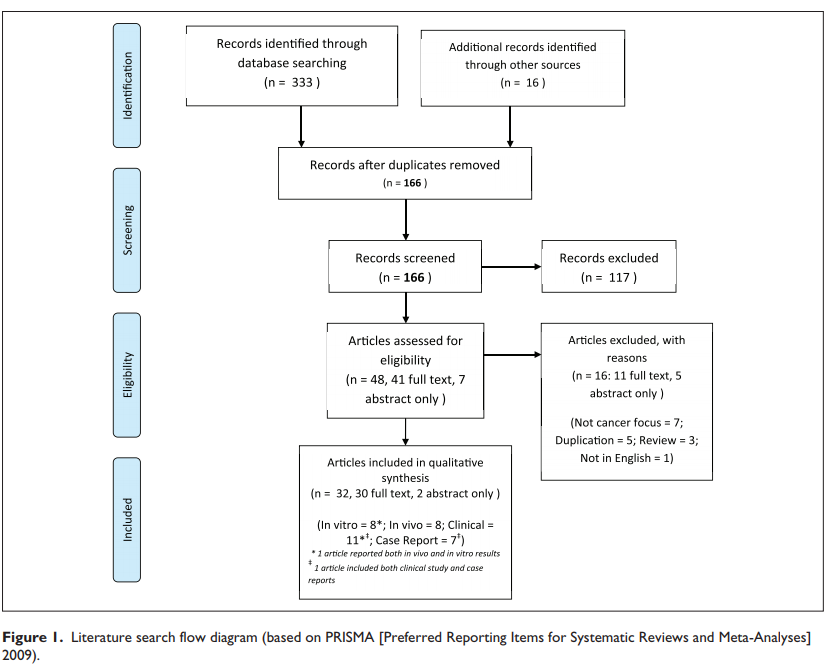
p.p1 {margin: 0.0px 0.0px 10.0px 0.0px; font: 11.0px Calibri; color: #000000; -webkit-text-stroke: #000000} span.s1 {font-kerning: none} span.s2 {font: 7.3px Calibri; font-kerning: none}
Рис. 1. Блок-схема поиска литературы (на основе PRISMA [предпочтительные элементы отчетности для систематических обзоров и Мета-анализов] 2009)
Исследования In Vitro
Характеристики исследований in vitro приведены в таблице 1. В этих исследованиях были продемонстрированы как иммуномодулирующие, так и синергические противоопухолевые эффекты MGN-3.
Иммуномодулирующее Противоопухолевое Действие.
Рост плоскоклеточной карциномы (SCC13) был остановлен после инкубации с MGN-3 в течение 72 часов.27 Остановка развития опухолевых клеток сопровождалась увеличением апоптоза при посредстве рецептора смерти CD95. В культуре опухолевых клеток (Т-клеточный лейкоз человека HUT 78), предварительно обработанных MGN-3 с агонистическим анти-CD95-антителом, наблюдалось увеличение скорости апоптоза более чем на 200%. Эффект был дозозависимым.28 По сравнению с покоящимися NK-клетками стимулированные MGN-3 NK-клетки индуцировали более высокую экспрессию ассоциированных с активацией рецепторов CD25 и CD69. Постоянно наблюдалось статистически значимое увеличение цитотоксичности стимулированных NK-клеток MGN-3 в отношении нескольких типов раковых клеток, но цитотоксичность в отношении нормальных клеток отсутствовала.34
Синергический Противораковый Эффект.
MGN-3 работает синергически с натуральными противораковыми продуктами, такими как как saccharomyces cerevisiae (сахаромицеты, пекарские дрожжи) и куркумин, равно как и с химиотерапевтическими препаратами (даунорубицином и паклитакселом) дозозависимым образом. Гонеум и Голлапуди 29,30 подтвердили способность MGN-3 ускорять ход фагоцитоза с пекарскими дрожжами при раке молочной железы и увеличивать индуцированный дрожжами апоптоз клеток рака молочной железы (BCCs).29,30 После инкубации различных BCCs (MCF-7, ZR-75, HCC70) с убитыми высокой температурой S. cerevisae и MGN-3 наблюдалось 2-кратное увеличение прикрепления и поглощения дрожжей обработанными клетками MCF-7, по сравнению с необработанными клетками, в зависимости от времени.30 Обработка с MGN-3 также привела к в 1.8-2.5-кратному увеличению процента апоптоза в различных клеточных линиях BCCs.29 Эффект фагоцитоза дрожжей и усиления апоптоза отсутствовал в нетуморогенных клетках молочной железы.30 Культивируя линию клеток множественной миеломы человека (MM) U266 с MGN-3 (50 или 100 мкг/мл) и куркумином (2,5-10 мкм) в течение 3 дней, Гонеум и Голлапуди32 также выявили, что пролиферация клеток U266 ингибируется MGN-3 при изолированном действии или куркумином при изолированном действии.32 Однако оптимальный синергетический эффект наблюдался при комбинации 100 мкг/мл MGN-3 и 10 мкм куркумина и характеризовался 87% снижением числа клеток U266 и 2,6-кратным увеличением процента апоптотических клеток U266.32
Показатели выживаемости BCC (клетки MCF-7 и HCC70) были измерены после культивирования в течение 3 дней с различными концентрациями даунорубицина (1 × 10-9 до 1 × 10-6 М) с добавлением или без добавления MGN-3 (100-1000 мкг / мл).31 Добавление MGN-3 привело к увеличению накопления даунорубицина в раковых клетках и значительному снижению выживаемости клеток MCF-7 (в 5,5 раза) и клеток HCC70 (в 2,5 раза) по сравнению с BCC, обработанными только даунорубицином. Было продемонстрировано, что MGN-3 с помощью аналогичного экспериментального исследования сенсибилизирует неметастатические BCC MCF-7 человека и метастатические мышиные BCC 4TI к паклитакселу, повышая их восприимчивость к химиотерапевтическому агенту более чем в 100 раз. Синергические эффекты включают повреждение ДНК, повышение апоптоза и ингибирование пролиферации клеток BCC.33
Исследования In Vivo
Параметры исследований in vivo приведены в таблице 2.
С помощью различных мышиных моделей эти исследования показали, что MGN-3 может потенциально предотвратить рак, ингибировать его рост и работать синергически с другими химиотерапевтическими агентами.
Профилактическое действие эффект против канцерогенных агентов.
Значительно более низкие показатели дисплазии и рака желудка наблюдались у самцов крыс Wistar, которым вводили канцероген метилнитронитрозогуанидин (MNNG) совместно с MGN-3, по сравнению с теми, кто получал только MNNG.39 Наблюдаемые превентивные эффекты MGN-3 включают подавление опухолевого маркера Ki-67 , повышение активности апоптотических клеток рака желудка через митохондриально-зависимый путь и защиту от снижения уровня лимфоцитов.39 Самцы крысы-альбиносов, предварительно обработанные MGN-3 до приема канцерогенного N-нитрозодиэтиламина (NDEA) и четыреххлористого углерода (CCl4), показали значительное снижение заболеваемости опухолями печени, заметное уменьшение процентной доли предэкластических очагов в паренхиме печени и ингибирование развития гепатоцеллюлярной карциномы по сравнению с контрольной группой. Обработанные MGN-3 крысы также могли поддерживать близкие к нормальным уровни диагностических маркеров печени.41
Таблица 1. Характеристика включенных исследований in Vitro.
|
№ |
Исследование |
Клетки-мишени |
Доза MGN-3 (мг/мл) |
Присоединяемый агент |
Продолжительность |
Результат |
|
1 |
Гонеум с соавт. (2000)27–только аннотация
|
Плоскоклеточный рак (SCC13)
|
Не указано |
Nil |
72 ч |
Снижение количества клеток на 30% после 48 ч и на 50% после 72 ч культивирования по сравнению с исходными значениями. Повышение внутриклеточного уровня ИЛ-10 и 12 без изменения уровня ИНФ-γ |
|
2 |
Гонеум и Голлапуди (2003)28
|
Клетки лейкоза человека (HUT 78) |
100, 300, 1000 |
Агонистические анти-CD95 антитела
|
3-24 ч |
увеличение предварительно обработанных MGN-3 апоптотических клеток на 200% по сравнению с исходными значениями |
|
3 |
Гонеум и Голлапуди (2005)29
|
Клетки рака молочной железы человека (BCC) MCF-7, ZR-75, HCC70
|
100, 500, 1000 |
Дрожжи-сахаромицеты в клеточной культуре в соотношение 1: 10 |
2 ч |
Дозозависимые эффекты ускорения фагоцитоза дрожжей клетками MCF-7, увеличенный апоптоз раковых клеток MCF-7 (2-хкратный), ZR -75 (в 2,5 раза) и HCC70 (в 1,8 раза) в пробирках с MGN-3 по сравнению с контролем |
|
4 |
Гонеум и Голлапуди (2005)30
|
Монослой BCC MCF-7 и нетуморогенного эпителия груди (MCF10A)
|
100 |
Дрожжи-сахаромицеты в клеточной культуре в соотношение 1: 10 |
1-4 ч |
Добавление MGN-3 привело к увеличению фагоцитоза дрожжей клетками MCF-7 (2-х кратному) и индуцированного дрожжами апоптоза по сравнению с контролем. Наблюдалось отсутствие фагоцитоза дрожжей клетками MCF-10A. |
|
5 |
Голлапуди и Гонеум (2008)31
|
BCC человека MCF-7 и HCC70
|
100, 500, 1000 |
Даунорубицин (1 × 10-9 до 1 × 10-6 М)
|
3 дня |
В пробирках с MGN-3 отмечалось повышение чувствительности MCF-7 (5.5- сложите) и HCC70 (2.5-fold) к даунорубицину. Также наблюдалось повышенное накопление даунорубицина в раковых клетках |
|
6 |
Гонеум и Голлапуди (2011)32
|
Клетки множественной миеломы человека (U266)
|
50 или 100 |
Куркумин (2,5-10 мкм) |
через 3 дня |
уменьшение количества клеток на 87% и увеличение в 2,6 раза процента апоптоза клеток U266 при добавлении 100 мкг / мл MGN-3 плюс 10 мкм куркумина. Эффект зависел от дозы. |
|
7 |
Гонеум с соавт. (2014)33 |
Неметастатические BCC человека (MCF-7) и метастатические мышиные BCC (4T1)
|
100, 250, 500, 600, 750, 1000 |
Паклитаксел (1 × 10-1 до 1 × 10-6 М)
|
24, 48 ч |
Добавление MGN-3 увеличило чувствительность раковых клеток обоих типов к паклитакселу в 100 раз; что достигается путем повреждения ДНК, усиления апоптоза и ингибирования пролиферации в клетках 4T1 |
|
8 |
Перез-Мартинез с соавт. (2015)34
|
Эритролейкемия (K562); Юркат-T лимфоидная лейкемия; саркома Юинга (A673); нейробластома (NB1691)
|
100 |
NK-клетки |
В течение ночи |
В простимулированных MGN-3 NK-клетки отмечалось повышение способности связываться с рецепторами CD25 и CD69 и активировать их; также было отмечено увеличение объема NK-клеток и их цитотоксической активности против всех клеточных линий |
p.p1 {margin: 0.0px 0.0px 10.0px 0.0px; font: 11.0px Calibri; color: #000000; -webkit-text-stroke: #000000} span.s1 {font-kerning: none} span.s2 {font: 7.3px Calibri; font-kerning: none}
Ингибирование роста раковых опухолей.
Самки швейцарских мышей-альбиносов, носители солидных опухолей карциномы Эрлиха (SEC), получали внутрибрюшинные инъекции MGN-3,37,38. По сравнению с мышами контрольной группы, у мышей, пролеченных MGN-3, наблюдалась значительная задержка роста опухоли. Это подтверждалось измерениями объема (у 63,27%) и веса новообразования (у 45,2%). При этом каких-либо связанных с лечением побочных эффектов не наблюдалось.37 Было показано, что противораковые механизмы MGN-3 являются иммуномодулирующими за счет регуляции фактора некроза опухоли-α (TNF-α) и интерферона-γ (IFN- γ) и подавления интерлейкина-10 (IL-10), а также индуцирования апоптоза в клетках SEC.37 В крови и печени обработанных MGN-3 животных отмечалось повышение уровней антиоксидантных ферментов, таких как супероксиддисмутаза, глутатионпероксидаза, каталаза и глутатион-S-трансфераза, до уровня, сопоставимого с нормой.38 Эффективность лечения MGN-3 была более выраженной у мышей, которые лечились на более ранних стадиях заболевания. Мышей NOD-scidIL-2Rgnull, которым привили клетки нейробластомы, лечили внутривенной NK-клеточной терапией, используя либо свежие NK-клетки, либо NK-клетки, активированные MGN-3 в течение ночи. У мышей, пролеченных активированными MGN-3 NK-клетками, были отмечено увеличение уровня маркеров активации NK-клеток, значительное ингибирование роста нейробластомы и более высокая выживаемость по сравнению с контрольными группами.34
Синергические эффекты с химиотерапевтическими агентами.
Самок швейцарских мышей-альбиносов, привитых клетками асцитной карциномы Эрлиха, лечили только паклитакселом, только MGN-3 или MGN-3 в комбинации с паклитакселом. Опухоли были значительно меньше по объему в группе MGN-3+паклитаксел: на 88% по сравнению с контрольной группой, на 77% – по сравнению с группой с паклитакселом и на 59% – с группой MGN-3. 40 MGN-3 также может потенциально защитить от неблагоприятного воздействия химиотерапевтических агентов. Белые крысы линии Sprague-Dawley, которых кормили MGN-3, были более здоровыми и набирали вес. После введения дозы цисплатина или доксорубицина у них были менее выражены проявления диареи и общей патологии кишечника по сравнению с контролем.35 Аналогично, прием внутрь и внутрибрюшинное введение MGN-3 защищал самок мышей с BALB от значительной потери веса, связанной с инъекцией цисплатина.36
Таблица 2. Параметры включенных исследований in Vivo.
|
№ |
Исследование |
Животная модель |
Доза MGN-3 |
Совместно используемый агент |
Продолжительность |
Результаты |
|
1 |
Якоби с соавт. (2001)35 |
Линия мышей-альбиносов Sprague-Dawley |
Прием внутрь в дозе 5 или 50 mg/kg ежедневно |
интраперитонеальная инъекция (IP) цисплатина или доксорубицина 1 раз в три дня
|
11 дней |
Получающие MGN-3 крысы были здоровее: набирали вес, у них была менее выражена диарея и иные проявления кишечной патологии по сравнению с контролем |
|
2 |
Эндо и Канбаяши (2003)36
|
Самки мышей с balb |
Водный раствор 0,1 мл (10 мг/мл) внутрь или IP ежедневно перед циспластином |
Однократное впрыскивание цисплатина (0.1 мл в концентрации 15 мг/кг)
|
28 дней |
В группе мышей, получавших MGN-3 (и при приеме внутрь, и при IP), отмечалось предотвращение выраженной потери веса тела из-за цисплатина. Результат был статистически значимым. |
|
3 |
Бадр Эль-Дин с соавт. (2008)37
|
Самки швейцарских мышей-альбиносов, привитые клетками асцитной карциномы Эрлиха (EAC), носители солидных опухолей
|
MGN-3 в 0.9% растворе хлорида натрия, вводимый внутрибрюшинно (IP) или в виде внутриопухолевых инъекций по 40 мг/на кг массы тела (BW) ежедневно на протяжении 5 недель |
Nil |
5 недель |
В обоих случаях на фоне лечения MGN-3 регистрировалось значительное замедление увеличения объема (на 63.27%) и веса опухоли (на 45.2%) по сравнению с контролем. Этому способствовало увеличение апоптоза клеток ЭАК (1.8- fold), влияющее на продуцирование цитокинов плазмы, ослабляющее подавление клеточного иммунитета цитокинами IL-10 и повышающее активность NK-клеток. Никакие неблагоприятные побочные эффекты, вызванные лечением MGN-3, не наблюдались. |
|
4 |
Ноаман с соавт. (2008)38 |
швейцарские мыши-альбиносы, привитые клетками EAC, носители солидных опухолей
|
MGN-3, растворенный в 0.9% солевом растворе и введенный посредством IP в дозе 25 мг/кг веса, 6 раз в неделю с 4-го - 11 дня после прививки и в конце (25 день)
|
Nil |
25 дней |
MGN-3 подавил рост опухолей; нормализовался повышенный уровень липидов перекисного окисления, содержание глутатиона, отмечалось повышение активности антиоксидантных ферментов в крови, печени и опухолевой ткани. Более выраженные эффекты лечения MGN-3 наблюдались при его раннем начале (на 4 день) |
|
5 |
Перез-Мартинез с соавт. (2015)34 |
Мышам линии NOD-SCIDIL-2rgnull вводился внутривенно (в/в ) вместе с NB-1691luc 2 × 105 клетками нейробластомы
|
100 мг/мл на протяжении всей ночи для активации NK-клеток
|
NK-клетки (необработанные или активированные MGN-3). NK-клеточную IV-терапию начинали через 7 дней после прививки опухолевых клеток, проводили два раза в неделю на протяжении 4 недель. |
4 недели |
MGN-3 стимулировал NK-клетки к подавлению роста нейробластомы и повышал выживаемость по сравнению с контролем. Результаты были статистически значимыми.
|
|
6 |
Бадр Эль-Дин с соавт. (2016)39 |
Самцы крыс линии Вистар |
1 доза 40 мг/кг веса в виде внутрибрюшинных вливаний через день на протяжении 8 мес.
|
Перорально канцероген MNNG (N-метил-N'-нитро-нитрозогуанидин) по 200 мг / кг веса ежедневно на протяжении 2 недель
|
8 мес. |
MGN-3 в комбинации с MNNG вызывал значительное снижение случаев дисплазии и рака желудка; наблюдаемые эффекты включали подавление маркера опухоли Ki-67, регуляцию апоптоза раковых клеток желудка через митохондриальный сигнальный путь и защиту от уменьшения уровня лимфоцитов |
|
7 |
Бадр Эль-Дин с соавт. (2016)40
|
Самки швейцарских мышей-альбиносов, привитые клетками EAC, носители солидных опухолей
|
1 доза 40 мг / кг веса тела в виде внутрибрюшинных вливаний Через день с 8 по 30 день |
Паклитаксел в дозе 2 мг/ кг веса через день, начиная с 8 дня по 30 день
|
30 дней |
MGN-3 в сочетании с паклитакселом вызывал значительное уменьшение объема опухоли (на 88%) по сравнению с лечением только паклитакселом (на 77%) или только MGN-3 (59%). Ингибирование опухолевого роста связано с уменьшением пролиферации раковых клеток, увеличением повреждения их ДНК и апоптозом |
|
8 |
Бадр Эль-Дин с соавт (2016)41– только абстракт
|
Самцы крыс-альбиносов |
25 мг / кг веса 5 раз в неделю внутрибрюшинно за 2 недели до получения канцерогенов и на протяжении 20 недель после
|
Канцероген NDEA (нитрозодиметиламин) (200 мг / кг веса тела) однократная доза внутрибрюшинно + промоутер CCl4 (3 мл/кг веса тела) еженедельно подкожно в течение 6 недель |
20 недель |
Было отмечено ингибирование MGN-3 индуцированного NDEA и CCI4 гепатокарциногенеза посредством индукции апоптоза и ингибирования пролиферации раковых клеток; AST, ALT, ALP и гамма-GT поддерживались на уровне, близком к нормальным значениям
|
Клинические случаи
В приведенных отчетах42-48 рассказано о 14 успешных клинических случаях терапии MGN-3. Характеристики и результаты лечения пациентов приведены в таблице 3. Большинство пациентов старше 50 лет, только двое моложе этого возраста, о возрасте еще 2 пациентов не сообщается. Типы первичного рака в этих случаях включали лейкемию (2), рак простаты (1), рак груди (1), колоректальный рак (2), рак поджелудочной железы (1), рак печени (3), рак легких (2), рак кожу (1) и рак яичника (1). Большинство пациентов начали принимать MGN-3 либо в сочетании с традиционным лечением рака, либо после его завершения. Дозировки MGN-3 составили 3 г / сутки, 6 г / сутки и 45 мг / на кг массы тела, препарат принимался перорально. В некоторых случаях MGN-3 сочетался с другими формами комплементарных терапий, включая ACM π-воду, 43 био-воспроизводящий белок (BRP), 44 и лектин омелы.46,47
Таблица 3. Характеристики пациентов и результаты включенных отчетов о клинических случаях.
|
№ |
Исследование |
Возраст пациента |
Тип рака |
Традиционное и вспомогательное лечение |
Доза MGN-3 |
Результаты |
|
1 |
Гонеум и Браун (1999)48
|
Мужчина, 39 лет, |
острый миелобластный лейкоз
|
Химиотерапия |
3 г/сут после химиотерапии
|
Количество лейкоцитов 5,6 × 109 /L после завершения химиотерапии с переходом на поддерживающее лечение. Активность NK-клеток возросла с 7,9 LUs до 113 LUs через 1 неделю после начала приема MGN-3 и поддерживалась на высоком уровне в течение 4 лет при контрольных измерениях |
|
Мужчина, 52 года |
острый миелобластный лейкоз
|
Нет сведений о традиционном лечении
|
3 грамма в день |
Перед лечением количество лейкоцитов составляло 18.7 × 109 /л После 1 месяца лечения этот показатель снизился до 11 × 109 /л. Состояние оставалось стабильным в течение 4 лет при контрольных измерениях |
||
|
|
|
Мужчина, возраст неизвестен
|
Рак простаты |
Гормональная терапия |
3 г в сутки после гормональной терапии
|
Уровень простат-специфического антигена (PSA) после гормональной терапии составил
в пределах нормы в течение 4 лет при контрольных измерениях |
|
|
|
Женщина, возраст неизвестен
|
Рецидив рака груди
|
Хирургия и химиотерапия
|
3 г в сутки после завершения химиотерапии
|
Активность NK-клеток увеличилась в 2 раза и достигла базового уровня (16,4 LUs) после 1 недели лечения. В дальнейшем увеличилась до 128 LUs и оставалась высокой в течение 4 лет при контрольных измерениях. Никаких доказательств рецидива не обнаружено при компьютерной томографии (КТ) или биопсии |
|
2 |
Каваи (2004)42 |
Женщина, 64 года |
Пуповинный метастаз рецидивирующего колоректального рака (метастаз медсестры Мэри Джозеф [SMJN]) |
5-ФУ 500 мг, Изоворин 250 мг (10A), Топотецин 40 мг вводили один раз в неделю с 19-го месяца и далее |
3 г в сутки в течение первых 18 мес.; 6 г в день впоследствии
|
Пациентка прожила 2 года и 2 месяца с момента обнаружения (среднее время жизни больных с этим диагнозом от 2 недель до 11 мес.) и была еще жива во время подготовки данного материала. MGN-3 помог продлить жизнь и улучшить ее качество |
|
3 |
Какетани (2004)43 |
мужчина, 64 года |
терминальная стадия рака поджелудочной железы с отдаленными метастазами
|
Пероральный прием противораковых лекарств (Фуртулон 1200 мг / за все время и Эндоксан 200 мг/за все время) ACM π вода (MRN100A) 300 мл/сутки.
|
6 г/сутки |
Согласно первоначальному прогнозу продолжительность жизни пациента составляла 3 мес. После 5 месяцев лечения КТ-изображения показали значительное уменьшение объема рака поджелудочной железы и метастазов в печени. При выполнении эндоскопии через 12 мес. после лечения аномалий практически не было. Пациент прожил 17 мес. с нормальным качеством жизни и умер от кровотечения при рвоте, не связанной с раком. |
|
4 |
Окамура (2004) 44 |
мужчина, 67 лет |
Рак печени с кишечным метастазом
|
Ранее проведенное лечение в другой больнице в течение года: внутривенные инфузии био-воспроизводящего протеина (BRP) раз в 4 недели
|
3 г/сутки с контролем на протяжении 157 дней
|
Первоначально прогнозировалось, что больной проживет не более месяца. Через 2 года после начала лечения было отмечено улучшение общего состояния, уровня онкомаркеров и и иммунокомпетентности. Лечение пациента продолжается 7-й год, на данный момент жизни его состояние нормальное и он получает лечение в амбулаторных условиях. |
|
|
мужчина, 65 лет |
Рак печени |
Ранее проводилось традиционное лечение в 2 других медицинских учреждениях, заключавшееся во внутривенных вливаниях BRP раз в 4 недели |
3 грамма в день в течение 72 дней |
Маркеры рака печени и иммунокомпетентность улучшились после 6 месяцев лечения. Первоначально повышенные уровни маркеров функции печени уменьшились через 1 год и исчезли вместе с желтухой, улучшился аппетит, боли ушли через 1 год и 11 мес. лечения |
|
|
|
Женщина, 71 год |
рак печени |
Первичное лечение в другой больнице с плохим результатом. Проводились внутривенные инфузии BRP раз в 4 недели
|
3 грамма в день на протяжении 392 дней
|
Уровень онкомаркеров печени снизился после 6 мес. лечения. Улучшилось клинические проявления и исчезла желтуха.
|
|
|
|
Женщина, 76 лет |
рак легких (аденокарцинома, распространение на оба легочных поля)
|
Начальное лечение, проведенное в другой больнице, не дало никакого улучшения. Проводились внутривенные вливания BRP раз в 4 недели
|
3 г/сутки на протяжении 128 дней
|
Уровень маркера опухоли легкого (тканевого полипептида антигена [ТПА]) снизился после 4 месяцев лечения. Уменьшился кашель. Началось постепенное улучшение иммунокомпетентности (активности Т-клеток ). |
|
|
|
Мужчина, 58 лет |
Рак прямой кишки с метастазами в печень
|
Перенес операцию в другой больнице. Внутривенное вливание BRP раз В 4 недели
|
3 г/сутки в течение 77 дней |
Функция печени (глутаминовая пировиноградная трансаминаза [GPT]), иммунокомпетентность (активность) Т-клеток быстро улучшились и стабилизировались через 1 мес. лечения. Пациент продолжал работать без субъективных симптомов во время контрольных наблюдений (наблюдение продолжается) |
|
|
5 |
Маркус с соавт.(2006)45 |
Мужчина, 68 лет |
метастатическая гемангиоперицитома кожи с множественными легочными узлами |
Широкое локальное удаление участка пораженной кожи. Пациент отказался от дальнейшего традиционного лечения легочных узлов |
Самолечение с неизвестными дозировками |
Легочные узлы последовательно уменьшались в размерах при периодической визуализации и перестали обнаруживаться после 34 мес. терапии MGN-3 |
|
6 |
Хаито с соавт. (2015)46 |
Женщина, 28 лет |
Саркома левого яичника и саркома эндометрия с метастазами в правый яичник |
Удаление левого яичника, а затем гистерэктомия и аднексэктомия. Химиотерапия по протоколу CYVADIC, начиная с 4-ой недели после второй операции. Лектин омелы в дозе 0,75 нг / кг дважды в неделю, начиная с 3-го цикла химиотерапии |
45 мг / кг дважды в неделю, начиная с 3-его цикла химиотерапии |
Наблюдалась быстрое улучшение качества жизнь после начала иммунотерапии (лектин + МГН-3). Пациентка лучше перенесла следующие 3 цикла химиотерапии. На время сообщения она была жива, после начала лечения прошло 5 лет. |
|
7 |
Хаито с соавт. (2016)47 |
Женщина, 74 года |
Неоперабельная аденокарцинома легкого
|
4 цикла карбоплатина и паклитаксела. Вторая линия лечения 75 мг / сут. эрлотинибом (Тарцева) проводилась в течение 7 мес. 0,75 нг / кг лектина омелы два раза в неделю. |
45 мг / кг дважды в неделю |
После лечения в течение 7 месяцев установлена почти полная ремиссия первичной опухоли и полная ремиссия всех метастазов. Качество жизни отличное, пациентка на 100% трудоспособна. |
В случаях нетерминального рака сообщалось о следующих результатах: улучшение опухолевых маркеров и профиля иммунокомпетентности, уменьшение изначально отмечавшихся симптомов44. Состояние пациентов стабильно без признаков рецидива рака при наблюдении48; а также пациенты показали улучшение субъективного качества жизни (QoL): улучшения сна, аппетита, пищеварения, физической активности, снижение тревоги и боли. Также отмечалось уменьшение побочных эффектов во время химиотерапии и ремиссии рака.46,47 В одном случае самолечения пациент отказался от дальнейшего традиционного лечения метастатической опухоли легкого после удаления первоначального поражения кожи. Метастатическая опухоль легкого после 34 месяцев самолечения MGN-3 не обнаруживалась.45. В 3 случаях терминального рака с плохим прогнозом, как сообщалось, пациенты смогли прожить дольше, чем изначально оценивался их срок жизни, при этом отмечалось улучшение их качества жизни QoL и даже нормальная трудоспособность.42-44
Клинические исследования
В этот обзор были включены 11 клинических исследований. Среди 11 клинических исследований 5 являются нерандомизированными пре/пост интервенционными 48,50,51,57,58 и 6 – рандомизированными контролируемыми (РКИ) .49,52-56. Параметры этих исследований суммированы в таблице 4 (нерандомизированные исследования) и таблице 5 (РКИ).
Нерандомизированные пре/пост интервенционные исследования.
Иммуномодулирующие эффекты MGN-3 были исследованы Гонеумом и Брауном.48 Тридцать два онкопациента (различные злокачественные опухоли) со сниженной активностью NK-клеток после традиционного лечения рака были пролечены MGN-3 в течение 2 недель. Наблюдалось значительное увеличение активности NK-клеток (до десятикратного). Увеличение концентрации NK-клеток и их связывающей способности, увеличение пролиферации T и B-клеток in vivo и опухоль-ассоциированных антигенов наблюдалось у отдельных пациентов.48 Аналогичным образом Цунекава50 сообщал о нормализации активности NK-клеток и улучшении клеток белой крови (лейкоцитов, WBC) в небольшом исследовании с участием 16-ти больных раком. Это были пациенты с различными злокачественными новообразованиями, которые прошли стандартную онкотерапию до начала терапии MGN-3 в течение 6 месяцев. Никаких субъективных или объективных побочных эффектов не было. В другом исследовании, однако, существенных изменений количества NK-клеток у 22 больных раком не наблюдалось после приема MGN-3 в течение 2 месяцев.51 Вместо этого наблюдался рост Т-хелперных (Th) -лимфоцитов по отношению к Т-регуляторным (Treg) лимфоцитам (CD4 + CD25 +) (Th: Treg), что демонстрировало эффект восстановления противоракового иммунитета на фоне терапии MGN-3. Тем не менее, из-за небольшого числа пациентов результаты не были статистически значимыми.51 Совсем недавно Голомбак с соавт. 57 сообщил, что комбинированная терапия MGN-3 и куркумином помогла 20 пациентам с ранними В-клеточными лимфоидными злокачественными опухолями сдержать прогрессирование заболевания, привела к увеличению количества нейтрофилов и снижению скорости оседания эритроцитов (СОЭ). Не было обнаружено существенных изменений количества клеток NK. Опять же, результаты этого исследования не имеют статистической силы.
Таблица 4. Характеристика включенных нерандомизированных клинических исследований.
|
№ |
Исследование |
N |
Тип рака |
Продолжительность |
Доза MGN-3 |
Традиционное и вспомогательное лечение |
Критерии эффективности |
Результаты |
|
1 |
Гонеум и Браун (1999)48
|
32 |
Рак простаты, рак груди, множественная миелома, лейкемия |
2 недели, наблюдение до 4 лет
|
Прием внутрь по 3 г / д |
Большинство пациентов проходили традиционное лечение перед исследованием
|
Активность NK клеток; зернистость NK ; пролиферация T и B клеток in vivo; опухоль-ассоциированные антигены (TAA)
|
Увеличение активность NK-клеток (до 10×); увеличение грануляции и связывающей способности NK-клеток ; пролиферация T и B клеток. Улучшение показателя ТАА у отдельных пациентов. Описаны результаты дальнейшего наблюдения за 4 пациентами |
|
2 |
Цунекава (2004)50 |
16 |
различные злокачественные новообразования |
6 мес. |
перорально 3 г/сут. |
больные прошли хирургию, лучевую терапию и/ или химиотерапевтическое лечение перед исследованием
|
Рост и вес тела, количество лейкоцитов и их разновидности, активность NK-клеток , онкомаркеры, неблагоприятные реакции и нарушения
|
Не выявлено субъективных или объективных отрицательных последствий. Улучшены показатели числа лейкоцитов и их разновидностей; в процессе и после лечения усиливалась и нормализовалась деятельность НК-клеток |
|
3 |
Лиссони с соавт. (2008)51
|
22 |
различные злокачественные новообразования |
2 мес. |
перорально по 2 г / сут. в первый месяц, и 1 г / сут. во второй месяц
|
Только поддерживающий уход, направленный на устранение боли, рвоты, тошноты и неопластической кахексии
|
Общее количество лимфоцитов, Т-лимфоциты (CD3+, СД4+, СД8+), Т-хелперы (Th), T-регуляторные клетки (Treg), NK-клетки
|
Статистически незначимое увеличение среднего количества Th-клеток с уменьшением клеток Treg. Среднее отношение Th / Treg значительно возросло. |
|
4 |
Голомбак с соавт. (2016)57
|
20 |
ранняя B-клеточная злокачественная лимфома (моноклональная гаммапатия неясного генеза [MGUS], «тлеющая» множественная миелома [SMM], хроническая лимфоцитарная лейкемия [CLL]) |
6 мес. |
Перорально по 2 г / д |
куркумин 6 г / д |
Лейкоциты, парапротеин, свободно варьируемые цепи / коэффициент, C-реактивный белок (CRP), скорость осаждения эритроцитов (СОЭ), В2 микроглобулин, sIgGs, поверхностные лейкоцитарные маркеры |
Увеличилось количество нейтрофилов у 80% пациентовс МГУС / СММ. Снизилась повышенная СОЭ на 40% у пациентов с MGUS / SMM
|
|
5 |
Хаито с соавт. (2016)58
|
35 |
различные злокачественные новообразования (главным образом II-IV стадия заболевания)
|
6 месяцев |
Перорально в дозе между 12 и 45 мг/ кг два раза в неделю
|
Обычная онкотерапия плюс 0.5-1.0 НГ/кг лектина омелы дважды в неделю
|
Анкетировалось качество жизни (боль, тревожность, физическая активность, аппетит, сон, пищеварение, побочные эффекты, улучшение самочувствия) |
Улучшение физической активности и снижение побочных проявлений во время обычной онкотерапии
|
Улучшение QoL на фоне приема MGN-3 были изучено исследователем Хаито с соавторами.58 В общей сложности 35 пациентов с различными злокачественными новообразованиями получали комбинацию лектина омелы и MGN-3 в качестве дополнительной терапии в течение как минимум 6 месяцев во время или после обычного лечения рака. Пациенты ответили на вопросник с бинарными ответами с 8 вопросами, касающимися различных аспектов их QoL после лечения, включая боль, беспокойство, физическую активность, аппетит и сон, сообщая о субъективном улучшении физической активности и уменьшении побочных эффектов как наиболее важных преимуществах дополнительной терапии.58
Рандомизированные контролируемые исследования.
Эффекты улучшения QoL MGN-3 были ранее изучены в большом РКИ с 205 раковыми больными с различными прогрессирующими злокачественными новообразованиями на поздних стадиях (III-IV).49 Проверка QoL пациентов путем наблюдения и диагностики во время исследования с использованием пользовательской шкалы оценки Тахара и Сано49 показала, что пациенты, получившие MGN-3 в комплексе со стандартной комплементарной и альтернативной терапией (CAT), достигли более высокой выживаемости (54,2% против 35,8%) и имели лучший аппетит, чем контрольная группа, которая получала только стандартный CAT. Не было четкой разницы между группами в отношении процентных изменений увеличении/ уменьшении активности NK, но группа MGN-3 + CAT имела более высокий процент пациентов с неизменной NK-активностью по сравнению с группой, получающей только CAT 49. Неясно, было исследование достаточно слепым.
Рандомизированное контролируемое клиническое исследование Банга с соавт. 52 можно рассматривать как первое клиническое доказательство противоопухолевой эффективности MGN-3. Участники этого 3-летнего РКИ состояли из 68 пациентов с раком печени I или II стадии. Более высокая выживаемость после второго года жизни (35% против 6,7%) и более низкий процент рецидивов заболевания (31,6% против 46,7%) у пациентов с раком печени, принимавших MGN-3, по сравнению с контрольными, были результатом применения MGN-3 в сочетании с традиционной онкотерапией у 38 пациентов.52 В качестве контроля были отобраны тридцать пациентов, получавших только обычные методы лечения. Также в группе MGN-3 наблюдалось значительное снижение уровня опухолевого маркера (α-фетопротеина [AFP]) и объема опухолей по сравнению с исходным уровнем, тогда как в контрольной группе не обнаружилось значительных изменений ни АФП, ни объема опухоли.52
Таблица 5. Характеристика включенных в отчет рандомизированных контролируемых клинических исследований.
|
№ |
Исследование |
N |
Тип онкологии |
Длительность |
Доза MGN-3 |
Традиционное и вспомогательное лечение |
Критерии эффективности |
Результаты |
|
1 |
Такахара и Сано (2004) 49
|
205 (MGN-3: 96, Контроль: 109)
|
Различные злокачественные новообразования
|
18 мес. |
Перорально по 3 г / д |
Комплементарная и альтернативная терапия, противораковые препараты |
Активность NK-клеток, выживаемость; персональная оценка качества жизни по уровню боли, недомогания, тошноты и аппетита
|
Группа MGN-3 достигла более высоких коэффициентов выживаемости и улучшения аппетита, чем контрольная группа |
|
2 |
Банг с соавт. (2010)52 |
68 (MGN-3: 38, Контроль: 30)
|
Гепатоцеллюлярная карцинома (стадии I и II)
|
3 года |
Перорально по 1 г / д на протяжении 12 месяцев во время лечения
|
Трансартериальная масляная химиоэмболизация (TOCE) или TOCE в сочетании с чрескожными инъекциями этанола (PEIT)
|
Общий ответ на лечение, уровни α-фетопротеина (АФП) , объем опухоли, рецидивы и выживаемость
|
Группа MGN-3 показала снижение количества рецидивов, более высокую выживаемость после 2-го курса, и значительное снижение уровня AFP по сравнению с контролем |
|
3 |
Холюжова с соавт. (2013)53
|
48 (MGN-3: 32, Плацебо: 16)
|
Множественная миелома |
3 мес. |
перорально по 2 г/сут |
чередующиеся курсы химиотерапии: алкилирующий агент, антрациклины и глюкокортикоиды
|
Иммунофенотипический анализ; активность NK -клеток ; профили цитокинов
|
Повышение активности NK -клеток, уровня миелоидных DCs, и увеличение концентрации цитокинов, связанных с активностью Th-клеток 1 Типа в группе MGN-3 по сравнению с группой плацебо |
|
4 |
Масуд с соавт. (2013)54 |
50 (MGN-3: 25, Контроль: 25)
|
Рак молочной железы |
6 мес. |
Перорально по 3 г / д в течение 1 недели до и 1 после каждого цикла химиотерапии
|
6 циклов химиотерапии
|
Индуцированные химиотерапией побочные эффекты (усталость, анорексия, рвота, выпадение волос)
|
В группе MGN-3 наблюдалось значительное снижение усталости; повышенный аппетит; не было потребности в противорвотных препаратах и отмечалось уменьшение интенсивности выпадения волос по сравнению с контрольной группой |
|
5 |
Итон с соавт. (2015)55 |
20 (MGN-3: 10, Плацебо: 10)
|
Рак шейки матки |
3 недели |
перорально по 3 г/д во время лучевой терапии
|
Лучевая терапия: сочетание дистанционной лучевой терапии и брахитерапии. Химиотерапия: цисплатин и 5-фторурацил
|
Желудочно-кишечные побочные эффекты химиолучевой терапии (диарея, тошнота, рвота, потеря аппетита, интоксикация); Подсчет лейкоцитов; деятельность NK-клеток
|
В группе MGN-3 реже выявлялась диарея, меньше снижался уровень лейкоцитов и было меньше других неблагоприятных проявлений, но результаты не были значимыми из-за отсутствия достаточной статистической мощности |
|
6 |
Петрович с соавт. (2016)56
|
50 (MGN-3: 25, Контроль: 25)
|
Различные злокачественные новообразования с синдромом хронической усталости
|
6 мес. |
Перорально по 3 г / д в течение 24 недель
|
Онкотермия (только для группы MGN3). Химио-или лучевая терапия как традиционное лечение
|
Оценка качества жизни (EORTC QLQ-C3), оценка боли (визуальная аналоговая шкала [VAS]), уровень pH тела, аномалии кроветворения , ЭКГ, анализ крови, уровень усталости (Анкета-опросник [CFQ]) |
Группа MGN-3 показала меньший сдвиг уровня рН тела в сторону кислой реакции. Средняя оценка CFQ была значительно ниже в группе MGN-3 по сравнению с отсутствием изменений в контрольной группе |
Было выявлено, что MGN-3 снижает вызванные химиотерапией побочные эффекты у пациенток с раком молочной железы, которые прошли 6 циклов химиотерапии в другом РКИ с 50 пациентами.54 MGN-3 было назначен 25 пациентам за 1 неделю до и 1 неделю после каждого цикла химиотерапии, при этом контрольная группа получала только химиотерапию. Побочные эффекты оценивались по индивидуальной анкете, заполняемой пациентами в начале каждого цикла. Сообщалось о значительном снижении усталости, повышенном аппетите, отсутствии потребностей в приеме противорвотных средств и уменьшении выпадения волос по сравнению с контрольной группой.54 В клиническом исследовании, опубликованном Итоном с соавт., с использованием специальной системы подсчета баллов было выявлено, что у проходящих химиолучевую терапию пациенток с раком шейки матки MGN-3 лучше, чем плацебо, снижает побочный эффект в форме диареи.55 Неблагоприятные последствия ХТ были оценены по шкале Национального института рака (общие терминологические критерии для неблагоприятных событий [CTCAE] v3.0). Только у 2 пациентов в группе MGN-3 развились осложнения 2-ой степени (умеренные) во время химиотерапии, а контрольная группа имела тенденцию к развитию побочных эффектов более высоких классов, чем группа MGN-3. Пациенты, принимавшие MGN-3, также показали меньшее снижение количества лейкоцитов. Однако результаты этого экспериментального исследования, в котором участвовало только 20 пациентов, были незначительными из-за отсутствия достаточной статистической мощности.55
В РКИ с 50 пациентами с CFS с различными злокачественными новообразованиями было выявлено, что у пациентов с синдромом хронической усталости (CFS), возникшим из-за рака или вследствие лечения рака, MGN-3 в комплексе с онкотермией может уменьшить симптомы CFS.56 25 пациентов, получавших 3 г / д MGN-3 и онкотермию раз в неделю имели значительно более низкие средние баллы по вопроснику усталости Чалдера (CFQ) по сравнению с исходным уровнем после 6 месяцев лечения. В контрольной группе пациентов, которые получали только обычную химиотерапию или лучевую терапию, не было отмечено значительного изменения средних показателей CFQ.56 Влияние MGN-3 на врожденный иммунитет изучалось Холюжовой с соавт.l53 в РКИ с 48 пациентами с множественной миеломой (MGN-3 группа - 32, плацебо - 16). Детальный анализ крови проводился до и в течение 3 месяцев лечения. Значительное увеличение активности NK, уровня миелоидных дендритных клеток и концентраций цитокинов, родственных Тh-клеткам 1-го типа, наблюдалось в группе MGN-3. Никаких существенных изменений в группе плацебо не наблюдалось. Следовательно, прием MGN-3 достоверно улучшил профиль врожденного иммунитета пациентов по сравнению с плацебо.53
Рис. 2. Риск систематической ошибки (смещения): обзор мнений авторов о каждом из факторов риска систематической ошибки для каждого включенного исследования.
Оценки риска смещения.
Мы оценили предвзятость проанализированных РКИ, используя Кокрановскую шкалу риска системной ошибки Биаса.59 Результаты оценки суммированы на рисунках 2 и 3. Из-за недостаточной информации о рандомизации и «слепоте», в большинстве проанализированных РКИ есть неотчетливый риск смещения, по крайней мере, в одном или нескольких элементах при отборе, в ходе исследования и при анализе результатов. Только исследование Итона с соавт.55 в этой статье считается с низким риском. Несмотря на это, данное исследование имеет высокий риск систематической ошибки выбора участников из-за того, что большой их процент (30%) исключается из оценки. 55 Риски систематических ошибок низкие в большинстве других исследований, за исключением исследования Масуда с соавт. 54, которое имеет неотчетливый риск смещения по всем пунктам оценки из-за недостаточной детализации опубликованной информации. Мы оцениваем исследование Такахара и Сано49 как имеющее высокие риски предвзятости. Это исследование было проведено коммерческой больницей, специализирующейся на комплементарной и альтернативной терапии больных раком, поэтому риск смещения не может быть исключен из-за конфликта интересов. Влияние фармацевтической промышленности является потенциальным источником предвзятости. Только в исследовании Петрович с соавт.56 предоставлена информация о финансировании и разъяснена роль партнеров по отрасли в исследовании, в других исследованиях эта информация не приводится.
Обсуждение
Имеющиеся на данный момент доказательства подтверждают, что MGN-3 относится к BRM. MGN-3 представляет собой научно обоснованный, стандартизованный концентрат арабиноксилана растительного происхождения, который подобно патогенассоциированным молекулярным паттернам может стимулировать естественную иммунную систему организма для защиты от роста рака.46 Влияние MGN-3 на повышение цитотоксической активности NK-клеток в несколько раз было наиболее заметно продемонстрировано в ряде исследований. 34,48-50,53 Противораковая активность NK-клеток является предметом интенсивных текущих исследований, а иммунотерапия NK-клетками рекламируется как будущее иммунотерапии рака.4 Повышение активности NK связано с хорошим прогнозом у пациентов с метастатическим раком. 60,61 Это может объяснить эффект продления срока жизни больных, принимавших MGN-3, о котором сообщается в ряде клинических исследований49,52 и в сообщениях о клинических случаях.42-44 Однако обработка MGN-3 не увеличивает абсолютные количества NK-клеток, как отмечено в клинических исследованиях, 51,57, что является ограничением. У пациентов с раком с низким количеством NK-клеток (0,15 × 109 / л), как правило, более низкие показатели выживаемости, 62,63, что указывает на то, что более низкий базовый уровень естественной противоопухолевой активности может снизить эффективность BRM. Хотя они могут в определенной степени извлечь пользу из усиления активности NK с использованием MGN-3, 49, сочетая NK-клеточную терапию64 с MGN-3, что может еще больше улучшить прогноз у этих пациентов – подход, который гарантирует будущее клиническое исследование.34
Другие иммуномодулирующие эффекты MGN-3 включают:
- повышение восприимчивости раковых клеток к апоптозу, опосредованному рецепторами смерти CD9528;
- влияние на продуцирование цитокинов плазмы (активирование TNF-α и IL-12 при подавлении IL-10) 37;
- усиление активности антиоксидантных ферментов38;
- улучшение пролиферации клеток Т и В48;
- улучшение концентрации Th-клеток, 51,53
- подавление клеток Treg51;
- активацию дендритных клеток.13,22,53
Эти эффекты были подробно представлены Гонеумом65 в недавнем обзоре, поддерживающем использование MGN-3 в качестве эффективного BRM в терапии рака.
MGN-3 был испытан в клинических исследованиях как вспомогательная терапия во время обычной химио- и лучевой терапии с эффектами, которые включают:
- улучшение иммунопрофиля, 53,55
- снижение побочных эффектов (диарея, тошнота, боль, усталость, анорексия , рвота), 52,54-56,58
- улучшение результатов лечения.52
Улучшение результатов и снижение побочных эффектов, в основном, объясняется улучшением баланса врожденной иммунной системы. Тем не менее, было показано, что MGN-3 также работает синергически с даунорубицином31 и паклитакселом33,40 в доклинических исследованиях, а также с трансартериальной масляной хемоэмболизацией (TOCE) и подкожной инъекцией этанола (PEIT) при лечении рака печени в клиническом исследовании 52 , то есть повышается сенсибилизация раковых клеток к этим агентам. Необходимо провести дополнительные исследования для изучения таких синергических эффектов с другими химиотерапевтическими средствами и лучевой терапией, чтобы полностью изучить потенциал MGN-3 в качестве комбинированной терапии при традиционной терапии рака.
Рис. 3. График риска смещения: обзор мнений авторов о каждом риске смещения элемента, представленного в процентах по всем включенным исследованиям.
В качестве последующей терапии после обычного лечения рака MGN-3 продемонстрировал эффекты восстановления ослабленного иммунопрофиля, 48-51 улучшение QoL и выживаемости пациентов с поздней стадией рака 49, а также сокращение числа рецидивов.52 Такие результаты согласуются с клиническим опытом, о котором сообщалось в опубликованных описаниях клинических случаев.42-47. Таким образом, MGN-3 также может рассматриваться как часть последующего поддерживающего лечения после обычной терапии рака. Не сообщалось о побочных реакциях в исследованиях, которые эксплицитно контролировали потенциальные побочные эффекты, вызванные MGN-3 in vivo37 и в клинических исследованиях50. Ни о каких неблагоприятных последствиях лечения MGN-3 не сообщалось ни в одном из включенных клинических испытаний или клинических случаев. Кроме того, безопасность MGN-3 изучалась в серии исследований на животных. Медианная летальная доза (LD50) MGN-3 составляет более 36 г / кг, а «отсутствие наблюдаемого уровня побочных эффектов (NOAEL)» составляет 200 мг / кг / д или выше.66 Поэтому стандартные дозы MGN-3 от 3 до 6 г / сут или 45 мг / кг веса в день являются чрезвычайно безопасными.
В настоящее время нет исследований по фармакокинетике MGN-3 и неизвестен уровень MGN-3 в сыворотке (личное сообщение из электронной почты доктора Мамду Гонеума в Университете медицины и науки имени Чарльза Дрю 4 августа 2017 года). Поскольку концентрации MGN-3, используемые в некоторых исследованиях in vitro, были очень высокими (500-1000 мкг / мл), 28,29,31,33, неясно, могут ли эти концентрации иметь клиническую значимость. Хотя дозы MGN-3 (5-50 мг / кг веса), используемые для исследований in vivo34,35,37-41, более точно соответствовали типичной дозе, используемой в исследованиях человека, без понимания фармакокинетики MGN-3, остаются вопросы, может ли более высокая биодоступность посредством внутрибрюшинной инъекции в некоторых исследованиях на животных 36-41 быть применима к людям.
Клинические исследования MGN-3 все еще находятся на ранней стадии, и только небольшое количество РКИ доступно в литературе. Большинство из них – небольшие экспериментальные испытания с ограниченным числом участников (N˂ 100) и короткими сроками (<= 6 месяцев). На данный момент доступно только одно РКИ для поддержки клинических доказательств.52 Другие РКИ, имеющие достаточное число участников (N = 205) и продолжительность (18 месяцев) 49, страдают от методологических ограничений, включая неадекватную «слепоту», отсутствие контроля плацебо и потенциальный риск смещения из-за конфликта интересов. Следовательно, необходимы большие, хорошо продуманные долгосрочные плацебо-контролируемые РКИ для дальнейшей оценки эффектов MGN-3 в качестве дополнительной терапии для поддержки традиционной терапии рака.
Заключение.
Имеющиеся в настоящее время данные доклинических исследований, клинических случаев и небольших клинических исследований показывают, что MGN-3 может быть эффективным BRM, дополняющим традиционную онкотерапию путем усиления иммунной системы пациента, особенно за счет повышения активности NK-клеток. MGN-3 представляется безопасным в применении, так как не имеется каких-либо неблагоприятных последствий, зарегистрированных на сегодняшний день. Он может использоваться в качестве дополнительной иммунной терапии для снижения побочных эффектов, улучшения результатов лечения и повышения долговременной выживаемости. Комбинация MGN-3 с новыми методами биологического таргетного лечения может открыть новые перспективы в терапии опухолей. Тем не менее, мы призываем к дополнительному изучению фармакокинетики MGN3, а также более тщательно разработанным РКИ для подтверждения его эффективности и укрепления доказательств в поддержку его клинического применения.
Заявление о наличии конфликта интересов. Автор(ы) не заявлял (и) о потенциальном конфликте интересов в отношении исследования, авторства и/или публикации данной статьи.
Финансирование. Автор (ы) не получили финансовой поддержки для исследования, авторства и/или публикации этой статьи.
06 Март 2015
06 Март 2015


