Арабиноксилан из рисовых отрубей (MGN-3 / Биобран) усиливает эффективность лучевой терапии у животных с асцитной карциномой Эрлиха †
Нариман К. Бадр Эль-Дин1 *, Саид К. Арейда1, Кван О. Ахмед2 и Мамду Гонеум3
1 Кафедра зоологии, Факультет науки, Университет Мансура, Мансура 35516, Египет
2 Университет Аль-Калам, Керкук, Ат-Таимим, Ирак
3 Отделение хирургии, Медицинский и научный университет им. Дрю, Лос-Анджелес, Калифорния 90059, США * Автор-корреспондент. Нариман К. Бадр эль-Дин, кафедра зоологии, факультет науки, Университет Мансура, Мансура 35516, Египет. Тел: +20 100 101 6511; Электронная почта: na_ri_eg@yahoo.com
† Данные были представлены на ежегодном собрании Американской ассоциации исследований рака (AACR) в Атланте, штат Джорджия. 29 марта - 3 апреля 2019 года. (Получено 8 февраля 2019 года; исправлено 22 мая 2019 года; решение редакции от 1 июля 2019 года)
АННОТАЦИЯ
В этом исследовании изучается способность арабиноксилана из рисовых отрубей (MGN-3 / Биобран) усиливать противораковое действие фракционированного рентгеновского облучения у мышей с солидными опухолями Эрлиха. Швейцарские мыши-альбиносы с опухолями подвергались следующему: (I) лечению Биобраном (40 мг / кг / день, внутрибрюшинные инъекции), начиная с 11 дня после инокуляции опухолевых клеток и до 30 дня; (II) ионизирующему излучению (Rad) 2 Гр в трех последовательных дозах на 12, 14 и 16 дни; или (III) Биобран + Rad. Конечная опухолевая масса был меньше на 46% в группе, получавшей Биобран, на 31% в группе, получавшей только облучение, и на 57% при комбинированном лечении (Биобран + Rad) по сравнению с контрольными необработанными мышами. Биобран и Rad также «арестовывали» гиподиплоидные клетки в суб-G1-фазе, показывая увеличение апоптоза на + 102% и + 85% соответственно, в то время как комбинированное лечение вызывало увеличение апоптоза на + 123% с аналогичными результатами степени фрагментации ДНК. Кроме того, комбинированное лечение Биобраном + Rad усиливало относительную экспрессию генов и уровень белка p53 и Bax в опухолевых клетках, подавляло экспрессию Bcl-2, увеличивало соотношение Bax / Bcl-2 и активность каспазы-3 более чем любое из моно-лечений. Кроме того, комбинированное лечение препятствовало снижению массы тела, увеличению массы печени и селезенки, а также способствовало повышению уровня печеночных ферментов аспартатаминотрансферазы, аланинаминотрансферазы и гамма-глутамилтрансферазы до нормальных значений. Мы пришли к выводу, что Биобран усиливает вызванную лучевой терапией регрессию опухоли путем потенцирования апоптоза и минимизации токсичности, связанной с лучевой терапией. Предположение, что Биобран может быть полезен для больных раком людей, проходящих лучевую терапию, требует клинических испытаний.
Ключевые слова: лучевая терапия; Биобран; апоптоз; in vivo (лабораторные испытания на животных)
© Автор (ы) 2019. Опубликовано издательством Oxford University Press от имени Японского общества радиационных исследований и Японского общества радиационной онкологии. Это статья открытого доступа, распространяемая в соответствии с условиями лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Загружено посетителем с https://academic.oup.com/jrr/advance-article-abstract/doi/10.1093/jrr/rr... 14 сентября 2019 года
ВВЕДЕНИЕ
Рак в настоящее время является второй по значимости причиной смерти во всем мире [1]. Он развивается из пролиферирующего клеточного клона с неконтролируемым ростом благодаря приобретению самодостаточности в сигналах роста, нечувствительности к сигналам против роста, способности избегать апоптоза и неограниченного репликативного потенциала [2]. Рак является одной из наиболее распространенных причин заболеваемости и смертности во всем мире - значительную долю этого бремени несут развивающиеся страны, на которые приходится почти 70% случаев смерти от рака в мире [1, 3–4].
Лучевая терапия продолжает оставаться одним из основных методов лечения различных видов рака. Однако эффективность лучевой терапии ограничена радиорезистентностью раковых клеток [5, 6], что требует очень высокой дозы для успешного уничтожения опухолей. Такие дозы в конечном итоге могут вызвать нежелательные осложнения для окружающих нормальных тканей и для отдаленных органов больного раком. Это накладывает серьезные ограничения на использование лучевой терапии [7]. Для радиационных онкологов и исследователей является серьезной проблемой разработка альтернативных подходов, которые можно использовать для усиления противоопухолевых эффектов лучевой терапии, минимизации дозы облучения и избежания вредных последствий лучевой терапии [8].
Исследователи начали сосредотачиваться на радиосенсибилизаторах, продуктах, которые могут снизить порог реакции раковых клеток на дозу облучения без повышения радиочувствительности нормальных клеток. Было показано, что радиозащитное и радиосенсибилизирующее действие оказывают различные натуральные продукты, такие как лекарственные растения и травы, а также полифенольные продукты, полученные из ягод и семян. К ним относятся растения Aegle marmelos, Aloe arborescens, Angelica sinensis и Aphanamixis polystachya [9]; растительные лекарственные средства, такие как эвгенол, эллаговая кислота, трифала, токоферол сукцинат и эмбелин [10–12]; и полифенольные продукты ресвератрол (из ягод) и (-) - госсипол (из хлопковых семян) [13, 14]. Вмешательство с радиосенсибилизаторами направлено на повышение эффективности лучевой терапии и уменьшение ее побочных эффектов за счет прогрессирования гибели раковых клеток путем апоптоза, снижения их устойчивости к лечению и детоксикации организма, уменьшения потери веса и недоедания, а также улучшения качества жизни. Учитывая, что более ранние исследования натурального продукта MGN-3 / Биобран (полученного из рисовых отрубей) продемонстрировали, что он обладает потенциальным ингибирующим действие на опухоль [15] и мощным хемосенсибилизирующим действием [16, 17], мы поставили цель в настоящем исследовании определить потенциал Биобрана для повышения терапевтической эффективности рентгеновского излучения (Rad) при облучении солидных опухолей.
Биобран получают путем взаимодействия гемицеллюлозы рисовых отрубей с комплексом гидролизующих углеводы ферментов из грибов шиитаке [18]. Сообщалось, что Биобран является мощным активатором человеческих NK-клеток у здоровых людей и у онкологических больных [19–21]. Кроме того, исследования in vivo на животных с опухолями показали, что Биобран обладает мощным ингибирующим действием на опухоль благодаря механизму, индуцирующему апоптоз опухолевых клеток [15]. Индукция апоптоза может контролировать реакцию опухолевых клеток на лечение противораковыми препаратами [22]. Кроме того, было показано, что Биобран является хемосенсибилизирующим агентом, который обладает большим потенциалом для адъювантной терапии при лечении рака: Биобран сенсибилизирует лейкозные клетки HUT 78 человека к апоптозу, индуцированному антителами против CD95 [23], сенсибилизирует клеточные линии MCF-7 рака молочной железы человека и метастатический рак молочной железы мышей 4T1 к паклитакселу in vitro [16], а также сенсибилизирует аденокарциному молочной железы к паклитакселу in vivo [17]. В настоящем исследовании изучается способность Биобрана усиливать воздействие Rad на клетки солидной карциномы Эрлиха, а также изучается основы молекулярного механизма его действия.
MATERIALS AND METHODS
MGN-3/Биобран
Биобран is a denatured hemicellulose obtained by reacting rice bran hemicellulose with multiple carbohydrate hydrolyzing enzymes obtained from Shiitake mushrooms. The main chemical structure of Биобран is arabinoxylan with an arabinose polymer in its side chain and a xylose in its main chain [18]. Биобран was provided by Daiwa Pharmaceutical Co. Ltd. (Tokyo, Japan) and was freshly prepared by dissolving in 0.9% saline solution and administered by intraperitoneal injections (i.p.) at a dose of 40 mg/kg body weight (BW)/ day, 5 times/week to mice with solid Ehrlich carcinoma. Treatment began on day 11 post-tumor cells inoculation and ended on day 30 for a total of 15 injections.
МАТЕРИАЛЫ И МЕТОДЫ
MGN-3 / Биобран
Биобран представляет собой денатурированную гемицеллюлозу, полученную путем взаимодействия гемицеллюлозы рисовых отрубей с комплексом гидролизующих углеводы ферментов, экстрагированных из грибов шиитаке. Основная химическая структура Биобрана – арабиноксилан с арабинозным полимером в его боковой цепи и ксилозой в основной цепи [18]. Биобран был предоставлен Daiwa Pharmaceutical Co. Ltd. (Токио, Япония), и был свежеприготовлен путем растворения в 0,9% физиологическом растворе. Применялся путем введения внутрибрюшинных инъекций (внутрибрюшинно) в дозе 40 мг / кг массы тела (BW) в день, 5 раз в неделю мышам с солидной карциномой Эрлиха. Лечение начинали на 11-й день после инокуляции опухолевых клеток и заканчивали на 30-й день, в общей сложности было выполнено 15 инъекций.
Рентгеновское облучение
Рентгеновское облучение проводилось в онкологическом центре Университета Мансура, Египет, с использованием линейного ускорителя LINAC. Животные получали рентгеновское ионизирующее излучение всего тела с уровнем дозы 6 Грэй (Гр), разделенным на три фракции (2 Гр каждая с мощностью дозы 0,85 Гр / мин) на 12, 14 и 16 дни после инокуляции клеток опухоли.
Приготовление клеток асцитной карциномы Эрлиха и трансплантация опухоли
Клетки асцитной карциномы Эрлиха (EAC) были великодушно предоставлены Национальным институтом рака, Каирский университет (Каир, Египет). Клетки поддерживали еженедельной внутривенной трансплантацией в дозе 2,5×106 клеток самкам швейцарских мышей-альбиносов. В этом эксперименте солидные опухоли были получены путем внутримышечной инъекции 0,2 мл клеток EAC (2,5 × 106 клеток) в правую мышцу бедра мышей. Жизнеспособность опухолевых клеток была определена как 95% с использованием метода исключения красителя трипанового синего. В исследовании использовали мышей с массой солидной опухоли (~ 300 мм3), которая развивалась в течение 9 дней после инокуляции.
Животные
Всего в этом исследовании было использовано 60 самок 2-месячных мышей швейцарских альбиносов весом 22 ± 2 г. Мыши были приобретены в Национальном институте рака, Каирский университет (Каир, Египет) и содержались при постоянной температуре (24 ± 2 ° C) 75 ° F, 10% -ной относительной влажности и чередующихся 12-часовых циклах света / темноты в нашем центре исследований на животных. Мышей в центре размещали за 1 неделю до начала экспериментов. Животным давали воду ad libitum («по желанию») и стандартные пищевые гранулы. Все эксперименты на животных проводились с разрешения Университета Мансура, Египет, и протоколы на животных соответствовали их Руководству по уходу и использованию лабораторных животных.
Экспериментальная конструкция
Мышей случайным образом разделили на шесть групп: (I) необработанная контрольная группа (8 мышей); (II) контрольная группа «Биобран»: контрольные мыши, получавшие только Биобран (8 мышей); (III) Инокулированная (инокулятная) контрольная группа: мыши-носители опухоли, получающие внутриопухолевые инъекции PBS (11 мышей); (IV) инокулированная группа Биобран: мыши-носители опухоли, получающие Биобран [40 мг / кг массы тела / день] (11 мышей); (V) инокулированная группа Rad (облученная): мыши-носители опухоли, подвергнутые облучению всего тела Rad в дозе (6 Гр), разделенной на три фракции (11 мышей); и (VI) инокулированная группа Биобран + Rad: мыши-носители опухоли, обработанные Биобраном (40 мг / кг массы тела / день) и подвергшаяся облучению всего тела Rad в дозе (6 Гр), разделенной на три фракции (11 мышей).
Отбор проб
В конечной точке эксперимента (30-й день) животных после 16-ти часового голодания анестезировали диэтиловым эфиром. С помощью вакуумных трубок кровь брали из брюшной аорты и оставляли сгуститься при комнатной температуре. Затем сыворотку отделяли центрифугированием при 3000 об / мин. в течение 20 мин и отправляли на хранение до анализа. Сыворотку крови использовали для определения параметров теста функции печени. Животных рассекали с целью получения солидной опухоли, печени и селезенки для выполнения различных анализов. Исследуемые параметры включали BW (вес тела), массу органа (печень и селезенка), объем опухоли (TV) и массу опухоли (TW). Регуляцию клеточного цикла, апоптоз и регуляторы апоптотического белка (р53, Bax, Bcl-2 и каспаза-3) определяли с помощью анализа проточной цитометрии, а относительную экспрессию гена (р53, Bax, Bcl-2) анализировали с использованием ПЦР в реальном времени. Повреждения опухолевой ДНК определяли с помощью гель-электрофореза, а апоптоз и некроз опухолевых клеток гистохимически исследовали с помощью флуоресцентной микроскопии.
Оценка массы тела и органа
На 30-й день определяли чистый конечный BW мышей и сравнивали его с начальным BW. Чистый конечный BW = конечный BW-TW. Прирост BW был определен как разница между начальным и чистым конечным BW. Массу органа, такую как вес печени и селезенки, исследовали на 30 день после скарификации животных.
Опухолевый рост
Рост опухоли определяли путем измерения TV и TW. Измерения ТV (временной интервал – 3 дня в неделю) проводились с 9 по 30 день после инокуляции клеток EAC с использованием цифровых штангенциркулей Вернье. Собранные данные были проанализированы с использованием следующей формулы для получения объема опухоли: TV (мм3) = 0,52AB2, где A - малая ось, а B - большая ось. Солидные опухоли были удалены в конце эксперимента для определения TW, сфотографированы и обработаны для различных анализов. Для справки: начальные TV на 9-ый день для групп Inocul Control, Inocul Биобран, Inocul Rad и Inocul Биобран + Rad составляли 342 ± 9,1, 367 ± 9,7, 388 ± 12,3 и 351 ± 8,0 мм3 соответственно.
Проточный цитометрический анализ
Клеточный препарат получали иссечением опухолевых тканей у мышей каждой группы, несущих ЕАС. Полученный образец разрезали на кусочки и протирали через тонкую нейлоновую марлю (40-50 ячеек / см; HD 140 Zuricher Buteltuch fabrik AG, Цюрих, Швейцария). Образцы промывали через марлю буфером трисэтилендиаминтетрауксусной кислоты (Трис-ЭДТА) при рН 7,5 [3,029 г 0,1 М Трис- (гидроксиметиламинометана), 1,022 г 0,07 М HCl и 0,47 г 0,005 М Трис-ЭДТА]. Клетки суспендировали в стерильном PBS, центрифугировали в течение 5 минут при 200–300 × g, ресуспендировали в PBS (плотность клеток ~ 1 × 106 клеток / мл), фиксировали в 70% ледяном этаноле, смешанном с PBS, хранили при -20 ° C до исследования.
Анализ клеточного цикла пропидия йодидом
Суспензии опухолевых клеток центрифугировали, осадок ресуспендировали в 1 мл раствора пропидия йодида (PI) и инкубировали в течение 30 минут в темноте. Последующие анализы проводили с использованием проточной цитометрии. Анализ данных выполняли с помощью программы анализа ДНК MODFIT (Verity Software House, Inc., Topsham, ME, USA). Для каждого образца программное обеспечение рассчитало коэффициент вариации вокруг пика G0 / G1 и процент клеток в каждой фазе (G0 / G1, S и G2 / M) клеточного цикла ДНК. Популяция анеуплоидных клеток считалась присутствующей, если отчетливый пик, в дополнение к диплоидному пику G1, отклонялся более чем на 10% от диплоидного внутреннего стандарта или если сам G1 отклонялся более чем на 10% от соответствующего пика G2 / M. Было рассчитано отношение индекса апоптоза (AI) / индекса пролиферации (PrI) [24].
Экспрессия белка, связанного с апоптозом
Антитела мыши против p53 (sc-7480), Bax (sc-7480), Bcl-2 (sc7382), каспазы-3 (sc-7272) и другие реагенты были приобретены у Santa Cruz Biotechnology, Inc., Даллас, Техас, США. Вторичные антитела были доступны в виде конъюгатов флуоресцеина [изотиоцианата флуоресцеина (FITC)] для проточной цитометрии. Опухолевые клетки (1 × 106) от мышей, которых лечили Биобраном и / или Радом, инкубировали с соответствующим антителом в течение 1 часа при комнатной температуре с последующим конъюгированием с FITC анти-кроличьими антителами козы. Клетки тщательно промывали фосфатно-солевым буфером и бычьим сывороточным альбумином и анализировали на проточном цитометре (Becton Dickinson, San Jose, CA, USA). Для анализа с использованием программного обеспечения CellQuest было получено в общей сложности 20 000 клеток, и для получения средних значений были использованы гистограммные графики зависимости FITC-флуоресценции от интенсивности логарифмической флуоресценции.
Анализ обратной транскрипционно-полимеразной цепной реакции апоптотических регуляторов
Следуя инструкциям производителя, полную экстракцию РНК проводили с использованием набора для экстракции общей РНК GF-TR-050 (Vivantis Technologies SDN. BHD., Малайзия). Общая РНК была обратно транскрибирована в кДНК с использованием набора FastQuant RT (Tiangen Biotech (Beijing) Co., Ltd). Набор содержал gDNase, которая удаляла геномную ДНК путем инкубации при 42 ° C в течение 3 минут, чтобы защитить анализ полной РНК от вмешательства геномной ДНК. Цепную реакцию обратной транскрипции-полимеразы в реальном времени (ОТ-ПЦР) проводили с использованием набора Maxima SYBR Green qPCR Master Mix (2 ×) (Thermo Scientific). Условия реакции и анализ данных использовали в соответствии с инструкциями изготовителя: 5 мкл кДНК в общем объеме 25 мкл, содержащие 12,5 мкл Maxima SYBR Green qPCR Master Mix (2 ×), прямой праймер 0,3 мкмоль, обратный праймер 0,3 мкмоль (праймеры показаны в таблице 1), 10 нМ / 100 н раствор ROX и доводили до 25 мкл водой без нуклеаз. Условия термоциклирования были следующими: при 95° С в течение 10 минут, затем 40 циклов при 95° С в течение 15 секунд, при 58° С в течение 30 секунд и при 60° С в течение 30 секунд. Реакции проводили с использованием системы ПЦР в реальном времени PIKO REAL 96 (Thermo Scientific).
Таблица 1. Праймеры, использованные для амплификации соответствующих генов в ОТ-ПЦР в реальном времени. p53, Bcl-2 и GAPDH разработаны (Vivantis, Малайзия), Bax by (Metabion, Германия).
|
Ген |
Прямой праймер |
Обратный праймер |
|
p53 |
5-GTC ACA GCA CAT GAC GGA GG-3 |
5-CTG TGG CGA AAA GTC TGC CT-3 |
|
Bax |
5-ATG CTC CAC CAA GAA GCT GA-3 |
5-AGC AAT CAT CCT CTG CAG CTC C-3 |
|
Bcl-2 |
5-GCG TCA ACA GGG AGA TGT CA-3 |
5-GCA TGC TGG GGC CAT ATA GT-3 |
|
GAPDH |
5-TGA TGG GTG TGA ACC ACG AG-3 |
5-GCC CTT CCA CAA CAA TGC CAA AG-3 |
Различия в экспрессии генов между группами определяли с использованием метода времени цикла [Ct] ΔΔC [25] и нормировали по конститутивному гену глицеральдегид-3-фосфатдегидрогеназой (GAPDH). Данные выражали в виде относительных уровней мРНК по сравнению с уровнем контрольной группы Inocul.
Обнаружение повреждения ДНК гель-электрофорезом
Выделение ДНК
Выделение ДНК из опухолевой ткани (30 мг) проводили с использованием набора геномной ДНК TIANamp (TIANGEN Biotech (Beijing) Co., Ltd), следуя инструкциям производителя.
Гель-электрофорез
Стандартный гель-электрофорез в агарозном геле использовали для разделения ДНК по размеру (например, длина в парах оснований), для визуализации и очистки образцов ДНК. Длина сегмента ДНК была определена с использованием ДНК-лестницы. После запуска гель анализировали с помощью гелевого анализатора Pro v3.1, который автоматически обнаруживал полосы и промежутки. Это также было проанализировано количественно с использованием программного обеспечения ImageJ v1.48.
Гистохимическая демонстрация апоптоза и некроза в опухолевой ткани
Апоптоз в опухолевых тканях каждой группы определяли с помощью совместного окрашивания акридин-оранжевым с этидий бромидом и исследовали под флуоресцентным микроскопом [26].
Пробоподготовка
Образцы опухолей фиксировали в 10% забуференном нейтральном формалине, обезвоживали и затем помещали в парафин. Срезы по 5 мкм устанавливали на предметное стекло на положительно заряженных предметных стеклах и депарафинизировали погружением в три смены ксилола на 5 минут каждый. Затем ткань регидратировали путем промывки в градуированном спирте по 3 минуты для каждого, после чего трижды промывали в PBS.
Окрашивание
Предметные стекла погружали в смесь 100 мкг / мл акридина оранжевого и 100 мкг / мл этидий бромида, свежеприготовленного в PBS. На полученных слайдах апоптотические и некротические клетки исследовали под флуоресцентным микроскопом с 4 ', 6-диамидино-2-фенилиндолдигидрохлоридом (DAPI), FITC и техасскими красными фильтрами (при 400 нм, 495 нм и 570 нм, соответственно). Количественный анализ был выполнен с использованием программного обеспечения для визуализации ZEN 2011 blue.
Анализ функции печени
Определение активности аланинаминотрансферазы и аспартатаминотрансферазы
Активность аланинаминотрансферазы (ALT) и аспартатаминотрансферазы (AST) в сыворотке крови определяли кинетическим методом, описанным Международной федерацией клинической химии (IFCC), с использованием диагностического набора, поставляемого ELITech Clinical System, France. Значение активности полученного коэффициента пропускания рассчитывали по следующей формуле:
Активность (Ед / л) = А / мин × 1746
Определение активности гамма-глутамилтрансферазы
Активность гамма-глутамилтрансферазы (GGT) в сыворотке крови анализировали с использованием диагностического набора, поставляемого ELITech Clinical System, France. Значение активности полученного коэффициента пропускания рассчитывали по следующей формуле:
Активность (Ед / л) = А / мин × 2211
Статистический анализ
Результаты выражали в виде среднего значения ± SE. Статистическая значимость была рассчитана с использованием однофакторного дисперсионного анализа (ANOVA) с последующими специальными тестами для сравнений с множественными показателями. Весь статистический анализ проводился с использованием программного обеспечения SPSS 17. Различия считались достоверными при P ≤ 0,05.
РЕЗУЛЬТАТЫ
Вес тела
Во время эксперимента еженедельно регистрировалась масса тела (BW) мышей из разных экспериментальных групп. На рисунке 1 показаны начальные и чистые конечные массы животных при различных условиях обработки. Начальный BW был сопоставим между группами; однако, после обработки (чистые конечные) BW показали заметные различия для инокулированных животных. По сравнению с исходными значениями у контрольных инокулированных животных (контрольных инокулятов) наблюдалось снижение массы тела на 18%. Обработка Биобраном сводила к минимуму потери BW (до 4,1%). Rad показал снижение BW на 31,2%, в то время как комбинация Биобран + Rad заметно уменьшила потери BW, зафиксировав снижение этого показателя на 17,9% по сравнению с инокулированными контрольными животными.
Объем опухоли
Рисунок 2 иллюстрирует влияние Биобрана и / или Rad на рост EAC после инокуляции, определяемый по кратному изменению TV (конечная опухоль / исходная опухоль). Обработка Биобраном приводила к непрерывному подавлению TV, которое достигло 33,7%, P <0,01 на 14-й день (2,35 по сравнению с 3,81 в контрольной группе) и достигло максимума снижения на 30-й день – 66,4%, P <0,01 (3,65 по сравнению с 11,64 в контрольной группе). Воздействие Rad вызвало снижение TV, которое достигло 49,9%, P <0,01 на 30-й день (5,14 по сравнению с 11,64 в контрольной группе). С другой стороны, комбинированное лечение (Биобран + Рад) привело к глубокому подавлению TV, которое достигло -42,0%, Р <0,01, на 14-й день (2,15 по сравнению с 3,81) и далее увеличилась до -77,3%, P <0,01 на 30 день относительно контрольных мышей Inocul (2,57 по сравнению с 11,64). Эти результаты хорошо иллюстрируют фотографии регрессии опухоли на рис. 3B.
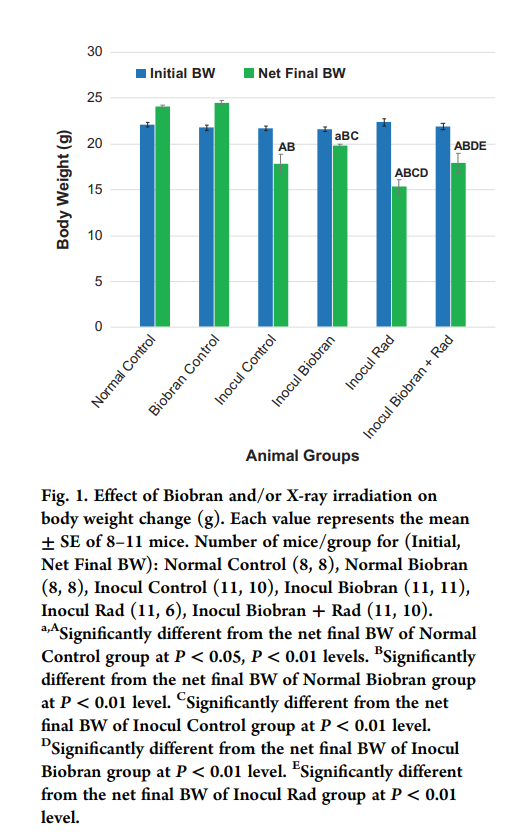
Рис. 1. Влияние Биобрана и / или рентгеновского облучения на изменение массы тела (г). Каждое значение представляет собой среднее значение ± SE для 8–11 мышей. Количество мышей в группах (начальный, чистый конечный BW): нормальный контроль (8, 8), нормальный Биобран (8, 8), инокулят контроль (11, 10), инокулят Биобран (11, 11), инокулят Rad (11 , 6), Инокулят Биобран + Рад (11, 10). А – значительно отличается от чистого конечного значения массы тела группы нормальных мышей (контроль) при P <0,05, P <0,01. B – значительно отличается от чистого конечного BW группы нормальных мышей (Биобран) при уровне P <0,01. C – значительно отличается от чистого конечного BW группы инокулированных мышей (контроль) при уровне P <0,01. D – значительно отличается от чистого конечного значения массы тела группы инокулированных мышей (Биобран) при уровне Р <0,01. E – значительно отличается от чистого конечного значения массы тела группы инокулированных мышей (Rad) при уровне P <0,01.
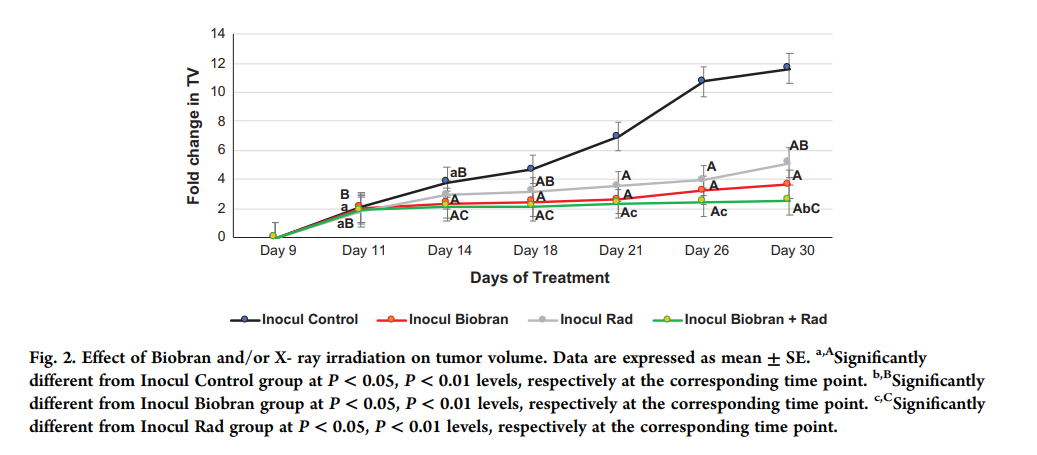
Рис. 2. Влияние Биобрана и / или рентгеновского облучения на объем опухоли. Данные выражены как среднее значение ± SE. А – значительно отличается от контрольной группы инокулированных мышей при P <0,05, P <0,01 соответственно в соответствующий момент времени. B – значительно отличается от группы инокулированных мышей (Биобран) при P <0,05, P <0,01 соответственно в соответствующий момент времени. С – значительно отличается от группы инокулированных мышей (Rad) при P <0,05, P <0,01 соответственно в соответствующий момент времени.
Вес опухоли
На 30-й день опухоли иссекали и взвешивали, чтобы оценить влияние различных методов лечения на TW. Как показано на рис. 3 A и B, обработка Биобраном вызывала заметное снижение TW на 46,3%, а воздействие Rad вызывало снижение на 30,7%. Тем не менее, подавляющий эффект Rad был дополнительно увеличен в присутствии Биобран и достиг 56,9% относительно контрольной группы Inocul.
Анализ клеточного цикла
Клеточный цикл анализировали с помощью проточной цитометрии окрашенных PI клеток, как показано в таблице 2. Количество гиподиплоидных клеток в суб-G1-фазе были заметно увеличено в группах, получавших только Биобран или Rad, на 102% и 85% соответственно по отношению к Инокулят-Контрольной группе. Комбинированное лечение с помощью Биобран + Rad значительно увеличило количество гиподиплоидных клеток в суб-G1-фазе, которое достигло 123% по сравнению с контрольной группой Inocul. Введение Биобран или фракционированного Rad животным-носителям опухоли, вызывало нарушение статуса клеточного цикла опухоли (фазы G0 / G1, S и G2 / M) без остановки клеточного цикла.
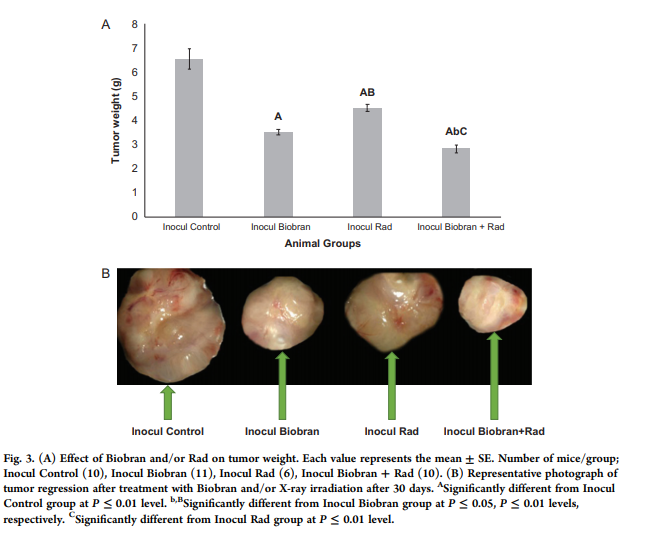
Рис. 3. (A) Влияние Биобрана и / или Рад на вес опухоли. Каждое значение представляет собой среднее значение ± SE. Количество мышей в группах: Инокулят Контрол (10), Инокулят Биобран (11), Инокулят Рад (6), Инокулят Биобран + Рад (10). (B) Репрезентативная фотография регрессии опухоли после лечения Биобраном и / или рентгеновского облучения через 30 дней. A – значительно отличается от группы Инокулят Контрол при уровне P ≤ 0,01. B – значительно отличается от группы Inocul Биобран при P ≤ 0,05, P ≤ 0,01, соответственно. C – значительно отличается от группы Inocul Rad при уровне P ≤ 0,01.
Таблица 2. Прогрессирование клеточного цикла в опухолевых тканях при различных условиях лечения. Каждое значение представляет собой среднее значение ± SE для пяти мышей / группы.
|
Параметр |
Инокуляты |
|||
|
Контроль |
Биобран |
Rad |
Биобран+ Rad |
|
|
Sub G1 (M1) |
36,7 ± 1,44 |
74,1 ± 0,48 * |
67,7 ± 1,37 *, ** |
81,9 ± 1,11 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
+102% |
+85% |
+123% |
|
G0 / G1 (M2) |
42,8 ± 1,46 |
17,3 ± 0,82 * |
19,5 ± 1,08 * |
12,3 ± 0,62 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
−60% |
-55% |
−71% |
|
S-фаза (M3) |
12,6 ± 0,29 |
6,0 ± 0,41 * |
8,3 ± 0,44 *, ** |
4,1 ± 0,37 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
−52% |
−34% |
−68% |
|
G2 / M (M4) |
6,5 ± 0,30 |
2,4 ± 0,45 * |
3,9 ± 0,11 *, ** |
1,9 ± 0,13 *, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
−62% |
−40% |
−70% |
* Значительно отличается от группы контроля инокулята при уровне P ≤0,01.
** Значительно отличается от группы Inocul Биобран при уровне P ≤0,01.
*** Значительно отличается от группы Inocul Rad при уровне P ≤0,01.
Влияние Биобрана и Рад на отношение индекса апоптоза / индекса пролиферации
Как показано на рисунке 4, обработка одним только Биобраном увеличила отношение AI / PrI в 2 раза, а обработка одной только Rad привела к увеличению отношения AI / PrI в 1,5 раза. Комбинация Биобран + Rad позволила максимизировать отношение AI / PrI до 2,2-кратного (P <0,01) по сравнению с контрольной группой Inocul.
Количественный гистохимический анализ апоптоза и некроза в опухолевой ткани
Количественное гистохимическое обнаружение апоптоза / некроза в опухолевой ткани проводили акридин-оранжевым-этидий бромидом (рис.5А и В). В опухолевых тканях мышей необработанной группы Inocul зарегистрировали 74,5 ± 2,25% жизнеспособных клеток, 18,2 ± 1,68% апоптотических клеток и 7,3 ± 1,4% некротических клеток. Опухолевые ткани группы Inocul Биобран показали 28,2 ± 1,25% жизнеспособных клеток, 53,1 ± 1,21% апоптотических клеток и 18,8 ± 0,96% некротических клеток. В опухолевых тканях животных, подвергшихся воздействию Rad, зарегистрировали 30,3 ± 1,23% жизнеспособных клеток, 41,3 ± 1,22% апоптотических клеток и 28,4 ± 0,89% некротических клеток. С другой стороны, в опухолевых тканях животных, получавших Биобран + Rad, было зарегистрировано 14,6 ± 0,93% жизнеспособных клеток, 64,0 ± 1,47% апоптотических клеток и 21,4 ± 1,7% некротических клеток.
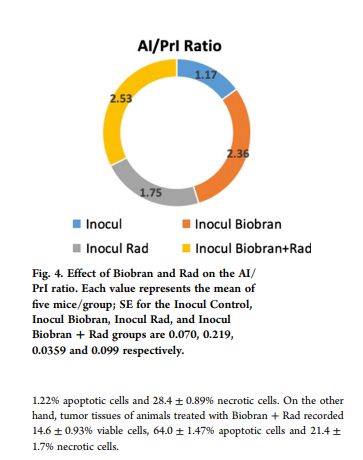
Рис. 4. Влияние Биобрана и Rad на отношение AI / PrI. Каждое значение представляет собой среднее значение для пяти мышей в группе; SE для групп Inocul Control, Inocul Биобран, Inocul Rad и Inocul Биобран + Rad составляют 0,070, 0,219, 0,0359 и 0,099 соответственно.
Анализ апоптотических регуляторов
Чтобы понять механизм, с помощью которого Биобран усиливал апоптотические эффекты фракционированного облучения, оценивали изменения уровней экспрессии апоптотических белков в опухолевых клетках различных групп, как это представлено в таблице 3. Значительная активация экспрессии для p53, Bax и каспазы -3 со значительным снижением экспрессии Bcl-2 наблюдалась в группах «Биобран + Rad» по сравнению с контролем, и эффект был больше, чем при любом ином лечении. Изменения в соотношении Bax / Bcl-2 показаны в Таблице 3 и на Рис. 6. Соотношение Bax / Bcl-2 было увеличено по сравнению с контролем в 3,4 раза для одной только Rad и максимально увеличено (в 9,5 раза) для комбинированного лечения.
Анализ экспрессии генов p53, Bax и Bcl-2 методом ОТ-ПЦР
Обнаружение экспрессии генов p53, Bax и Bcl-2 в опухолевых тканях различных групп с помощью количественной ОТ-ПЦР показано в таблице 4. Обработка только Биобраном мышей с опухолями значительно повышала экспрессию генов p53 и Bax на 149,4 и 133,2% соответственно и понижало экспрессию гена Bcl-2 на 65,2% по сравнению с контрольной группой Inocul.
Воздействие Rad усиливало экспрессию p53 и Bax на 58,8 и 43,4% соответственно и уменьшало экспрессию Bcl-2 на 36,4% относительно контрольной группы Inocul. Комбинированное лечение с помощью Биобран + Rad дополнительно увеличивало усиление экспрессии p53 и Bax на 284,9 и 244,1% соответственно, и экспрессия Bcl-2 была заметно подавлена – на 95,4% по сравнению с контрольной группой Inocul.

Рис. 5. (A) Гистохимическое определение % апоптоза и некроза в опухолевых тканях разных групп. Каждое значение представляет собой среднее значение ± SE для пяти образцов опухоли в каждой группе. (B) Типичные флуоресцентные микрофотографии срезов мышей Inocul, обработанных Биобраном и / или рентгеновским облучением, окрашенных акридиновым оранжевым и бромидом этидия, демонстрирующих апоптоз и некроз. (i) необработанный инокулят; (ii) Инокулят Биобран; (iii) Инокулят Рад; (iv) Инокулят Биобран + Рад. Акридиновый оранжевый и бромид этидия. 50 ×. Жизнеспособные клетки: зеленый цвет, апоптотические клетки: от желтого до светло-оранжевого, некротические клетки: от темно-оранжевого до красного.
Обнаружение повреждения ДНК гель-электрофорезом
Чтобы понять механизм того, как Биобран усилил апоптотический эффект радиотерапии путем апоптоза на основе ядерной фрагментации ДНК, характерного признака апоптоза, был исследован электрофорез в ДНК-геле с использованием характерных лестниц фрагментации ДНК, которые обозначают апоптоз. Как показано на рис. 7 A и B, контрольные необработанные опухолевые клетки продуцировали 7,6 ± 4,5% фрагментации ДНК и не показали образования лестниц. Обработка Биобраном произвела 86,2 ± 4,3% фрагментации ДНК, а воздействие Rad привело к 61,6 ± 17,1% разорванных нитей ДНК, тогда как обработка Биобран + Rad показала самый высокий процент расслоения ДНК (91,7 ± 5,6%).
Таблица 3. Влияние Биобрана и / или Рад на апоптотические регуляторы в опухоли; каждое значение представляет собой среднее значение ± SE для 5 образцов опухоли в группе.
|
Параметр |
Инокуляты |
|||
|
Контроль |
Биобран |
Rad |
Биобран+ Rad |
|
|
Экспрессия р53 |
15,67 ± 0,41 |
33,50 ± 0,26 * |
31,15 ± 0,16 *, ** |
45,05 ± 0,23 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
+113,78% |
+98,78% |
+187,49% |
|
Экспрессия Bax |
12,34 ± 0,12 |
26,42 ± 0,77 * |
23,78 ± 0,27 *, ** |
37,03 ± 0,34 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
+114,1 % |
+92,7% |
+200,08% |
|
Экспрессия Bcl-2 |
51,12 ± 0,35 |
23,86 ± 0,37 * |
29,14 ± 0,11 *, ** |
16,24 ± 0,22 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
−53,32% |
−42,99% |
−68,23% |
|
Соотношение Bax / Bcl-2) |
0,242 ± 0,003 |
1,108 ± 0,036 * |
0,816 ± 0,008 *, ** |
2,283 ± 0,049 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
+ 358,9% |
+ 237,9% |
+ 845,3% |
|
Экспрессия Каспазы-3 |
23,89 ± 1,86 |
53,32 ± 1,76 * |
38,64 ± 2,08 *, ** |
71,6 ± 1,74 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
+123,22% |
+61,78% |
+ 199,77% |
* Значительно отличается от группы контроля инокулята при уровне P ≤0,01.
** Значительно отличается от группы Inocul Биобран при уровне P ≤0,01.
*** Значительно отличается от группы Inocul Rad при уровне P ≤0,01.
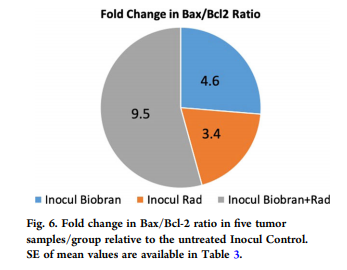
Рис. 6. Кратность изменения соотношения Bax / Bcl-2 в пяти образцах опухоли на группу по сравнению с необработанным контрольным инокулятом. SE средних значений приведены в таблице 3.
Влияние Биобрана и / или Рад на вес органа (вес печени и вес селезенки)
На 30-й день образцы печени и селезенки из каждой экспериментальной группы вырезали и взвешивали. Изменения массы органов показаны в таблице 5. Обработка одним Биобраном нормальных животных показала незначительное изменение массы печени (LW) по сравнению с нормальными контрольными животными. По сравнению с нормальной контрольной группой увеличение LW при различных обработках показало следующее: контрольные мыши Inocul 70,0%, Биобран 14,3%, Rad 52,9% и Биобран + Rad минимизировали увеличение LW до 16,4%.
Контрольные мыши с инокулятом показали значительное увеличение массы селезенки (SW) по сравнению с нормальной контрольной группой. Обработка одним только Биобраном или одним облучением показала значительное снижение SW по сравнению с контрольной группой Inocul. Напротив, комбинация Биобран + Rad показала SW, сопоставимые с нормальной контрольной группой. Никаких значительных изменений в SW не наблюдалось у нормальных мышей, получавших только Биобран, по сравнению с нормальными контрольными мышами (таблица 5).
Ферменты печени
Данные в Таблице 6 представляют уровни активности ферментов функции печени AST, ALT и GGT в сыворотке мышей при различных экспериментальных условиях. Контрольные мыши с инокулятом продемонстрировали заметное повышение уровней AST (165,7%), ALT (214,2%) и GGT (186%) по сравнению с нормальной контрольной группой. Радиационное облучение зафиксировало значительное повышение уровня печеночных ферментов AST, ALT и GGT до 189,8, 234,4 и 234,4% соответственно по сравнению с нормальной контрольной группой. Введение Биобрана улучшило функцию печени, вызывая заметное снижение повышенных уровней AST, ALT и GGT до 86,8, 137,6 и 108,6% соответственно по сравнению с нормальной контрольной группой. Биобран + Rad значительно минимизировал повышение уровней AST, ALT и GGT до 44,4, 97,2 и 71,8% соответственно по сравнению с нормальной контрольной группой.
Таблица 4. Влияние Биобран и / или Rad на относительную экспрессию генов p53 'Bax и Bcl-2 в опухолевых тканях, определенную методом RT-PCR. Относительную экспрессию генов количественно определяли с помощью GAPDH в качестве внутреннего контроля. Данные были представлены в % увеличения или уменьшения по сравнению с уровнями контрольной группы инокулята. Относительная экспрессия гена контрольной группы инокулята была определена как 1. Каждое значение представляет собой среднее значение ± SE для пяти образцов опухоли в группе.
|
Параметр |
Инокуляты |
|||
|
Контроль |
Биобран |
Rad |
Биобран+ Rad |
|
|
Ген р53 |
1 |
2,49 ± 0,15 * |
1,58 ± 0,14 †, ** |
3,84 ± 0,23 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
+149,4 |
+58,8 |
+284,9 |
|
Ген Bax |
1 |
2,33 ± 0,19 * |
1,43 ± 0,16 ** |
3,44 ± 0,43 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
+133,2 |
+43,4 |
+244,1 |
|
Ген Bcl-2 |
1 |
0,348 ± 0,045 * |
0,636 ± 0,052 *, ** |
0,046 ± 0,014 *, **, *** |
|
Изменение в % по сравнению с контрольной группой Inocul |
|
-65,2 |
-36,4 |
-95,4 |
* Значительно отличается от группы контроля инокулята при уровне P ≤0,01.
** Значительно отличается от группы Inocul Биобран при уровне P ≤0,01.
*** Значительно отличается от группы Inocul Rad при уровне P ≤0,01.
ОБСУЖДЕНИЕ
Лучевая терапия остается важным методом лечения рака, поэтому минимизация токсичности, связанной с лучевой терапией, стала главным приоритетом. Было показано, что повышение радиореактивности опухолей с помощью природных радиосенсибилизирующих агентов является многообещающим подходом для повышения эффективности лучевой терапии, и это привело нас в текущем исследовании к изучению потенциальных полезных эффектов Биобрана при использовании совместно с радиотерапией. Результаты этого исследования показывают, что, хотя лечение одним только Биобраном или одним только облучением эффективно ингибировало рост опухоли (объем и вес), комбинированное лечение (Биобран + Rad) приводило к ее большей регрессии. При изучении механизма действия Биобрана анализ развития клеточного цикла показал, что комбинированное лечение значительно увеличивало накопление гиподиплоидных клеток в фазе суб-G1. Накопление суб-G1 клеток означает апоптоз, и при комбинированном лечении это накопление достигло 123% по сравнению с контролем (P <0,01), увеличение было выше, чем при любом отдельном лечении. Это увеличение не привело к значительной остановке других фаз клеточного цикла. Кроме того, комбинированное лечение увеличивало отношение AI / PrI в 2,2 раза по сравнению с контролем, в то время как лечение одним только облучением увеличивало отношение только в 1,5 раза.
ДНК-гель-электрофорез выявил, что повреждение ДНК опухолевых тканей, обработанных Биобраном + Рад, показало наивысшую степень ДНК-лестничности. Двойное окрашивание аннексином V / PI также показало, что комбинированное лечение с помощью Биобран + Rad показало большую индукцию раннего апоптоза и глубокое ингибирование в популяции жизнеспособных клеток, более высокое, чем при любом моно-лечении (данные не показаны). Несколько исследований показали, что индукция апоптоза в раковых клетках играет важную роль в эффективности лучевой терапии, и это считается основным способом радиационно-индуцированной регулируемой гибели клеток. Излучение может напрямую влиять на структуру двойной спирали ДНК, что, в свою очередь, активирует рецепторы повреждения ДНК, запускающие апоптоз и некроз. Ответы опухолевых клеток на тяжелое радиационное повреждение ДНК передаются с помощью рецепторов повреждения ДНК и регуляторов клеточного цикла и могут быть разделены на три этапа: индукция повреждения ДНК, активация сигнального пути повреждения ДНК и восстановление повреждения ДНК [27, 28].
Способность Биобрана усиливать реакцию раковых клеток на лучевую терапию также изучалась на молекулярном уровне. ОТ-ПЦР и анализ с помощью проточной цитометрии показали, что лечение с помощью Биобран + Rad значительно усиливало экспрессию проапоптотических генов p53 и Bax и подавляло экспрессию антиапоптотического гена Bcl-2 в гораздо большей степени, чем при моно-лечении Биобраном или радиацией. Кроме того, комбинированное лечение максимизировало процентное отношение экспрессии белка Bax к Bcl-2 в опухолевых клетках. Сверхэкспрессия Bax, а также p53, связана с синергетическим эффектом Биобрана на раковые клетки. Это подтверждает предыдущие сообщения о лечении раковых клеток in vitro и in vivo госсиполом или куркумином плюс Rad, где комбинированная терапия показала наибольшее увеличение апоптотических клеток [14, 29]. Другие исследования также выявили прямую корреляцию между степенью индуцированного апоптоза и ответом клетки на облучение [30]. Наши результаты демонстрируют, что степень апоптотического эффекта Rad в раковых клетках значительно усиливается добавлением лечения Биобраном.
Белки семейства Bcl-2, состоящие из антиапоптотических и проапоптотических элементов, определяют жизнь или гибель клетки [31]. Максимизация процентного отношения экспрессии белка Bax к Bcl-2 в опухолевых клетках при комбинированной обработке (Биобран + Rad) приводила к активации пути каспазы-3. В текущем исследовании уровень белка каспазы-3 был значительно повышен после лечения Биобраном + Rad и достигал более высокого уровня, чем при лечении только Rad. Это указывает на то, что вызванный Биобраном апоптоз происходит по митохондриальному пути. Роль Биобрана в активации каспаз-3, 8 и 9 и в индукции апоптоза была продемонстрирована ранее [23]. Расщепленная каспаза-3 считается ключевым исполнителем апоптоза и необходима для фрагментации ДНК и конденсации хроматина [32]. Таким образом, потенцирование Биобраном апоптоза, спровоцированного лучевой терапией, можно считать результатом усиления регуляторов апоптоза.
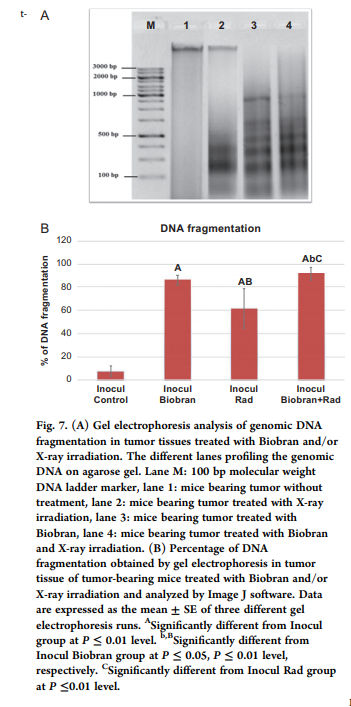
Рис. 7. (A) Гель-электрофорезный анализ фрагментации геномной ДНК в опухолевых тканях, обработанных Биобраном и / или рентгеновским облучением. Различные дорожки, профилирующие геномную ДНК на агарозном геле. Дорожка М: маркер лестничной ДНК с молекулярной массой 100 п.н., дорожка 1: мыши с опухолью без обработки, дорожка 2: мыши с опухолью, обработанной рентгеновским излучением, дорожка 3: мыши с опухолью, обработанной Биобраном, дорожка 4: мыши с опухолью, обработанная с Биобраном и рентгеновским облучением. (B) Процент фрагментации ДНК, полученной гель-электрофорезом в опухолевой ткани у мышей с опухолями, обработанных Биобраном и / или рентгеновским излучением и проанализированных с помощью программного обеспечения Image J. Данные выражены в виде среднего значения ± SE для трех разных прогонов гель-электрофореза. A – Значительно отличается от группы инокулятов при уровне P ≤ 0,01. b, B – значительно отличается от группы Inoсul Биобран при P ≤ 0,05, P ≤ 0,01, соответственно. C – Значительно отличается от группы Inocul Rad при уровне P ≤0,01.
Также здесь была изучена защитная роль Биобрана против возможных побочных эффектов, вызванных радиацией и опухолевой нагрузкой. Настоящие результаты показали, что лечение Биобраном отдельно или в сочетании с Rad предотвращало потерю BW и поддерживало вес печени и селезенки близкими к нормальным значениям. Эти результаты согласуются с более ранними исследованиями, показывающими, что Биобран обеспечивает защиту от потери BW, вызванной облучением [33], и действует как адъювант перед началом химиотерапии для поддержания нормального BW в сочетании с химиотерапевтическими препаратами, такими как паклитаксел, цисплатин или доксорубицин. [16, 34, 35]. Благоприятная роль Биобрана была подтверждена в клинических испытаниях пациентов с гепатоцеллюлярной карциномой: показано, что лечение Биобраном снижает вероятность рецидива рака и увеличивает продолжительность жизни после химиотерапии [36]. Способность Биобрана противодействовать повреждающему действию радиации до конца не изучена, но его можно отнести к дополнительным эффектам Биобрана на иммунные клетки. Ранее проведенные исследования показали, что Биобран является мощным модификатором биологического ответа, который, как известно, активирует дендритные клетки [37, 38], повышает активность NK-клеток [19, 39], модулирует цитокины и индуцирует апоптоз в опухолевой ткани [15].
Наши результаты также показали, что лечение Биобраном, отдельно или в комбинации с радиацией, обеспечивало дополнительный радиозащитный эффект, заметно снижало повышение уровня ферментов печени AST, ALT и GGT. Это подтверждает защитную роль Биобрана против радиационных поражений гепатоцитов. Ранее было показано, что Биобран улучшает функцию печени в результате своей антиоксидантной активности, нормализуя уровни перекисного окисления липидов, увеличивая содержание глутатиона и повышая активность антиоксидантных ферментов SOD, GPx, CAT и GST в крови и печени мышей-носителей опухоли [40]. Известно, что облучение всего тела любым видом радиации изменяет общую физиологию животного [41], а ионизирующее излучение оказывает свое неблагоприятное воздействие посредством генерации окислительного стресса, который вызывает широкомасштабное разрушение или повреждение различных биомолекул [42–44]. ]. Эти свободные радикалы реагируют с тканями организма и вызывают перекисное окисление липидов, повреждения ДНК и инактивацию ферментов, которые являются медиаторами радиационного повреждения. Результаты текущего исследования хорошо коррелируют с другими, в которых сообщалось, что сыворотки облученных животных имеют повышенные уровни АСТ, АЛТ и ГГТ [45, 46]. Как было показано, Биобран защищает от повышения этих показателей.
В заключение. Данное исследование демонстрирует, что MGN-3 / Биобран, натуральный и безопасный продукт, извлеченный из рисовых отрубей, может служить средством повышения эффективности лучевой терапии. Эти эффекты могут быть достигнуты посредством наблюдаемой усиленной индукции апоптоза опухолевых клеток, а также защиты массы тела и органа, уровня ферментов печени. Результаты позволяют предположить, что Биобран можно использовать для усиления терапевтического эффекта ионизирующего излучения при лечении солидных опухолей и для минимизации его побочных эффектов на нормальные клетки.
06 Март 2015
06 Март 2015


